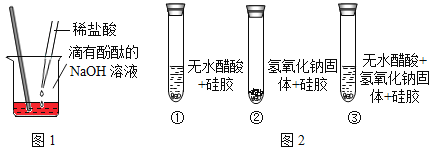
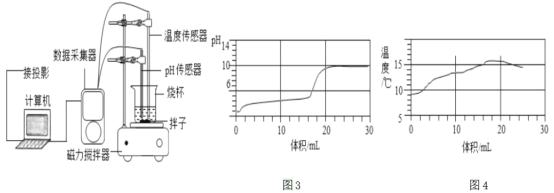
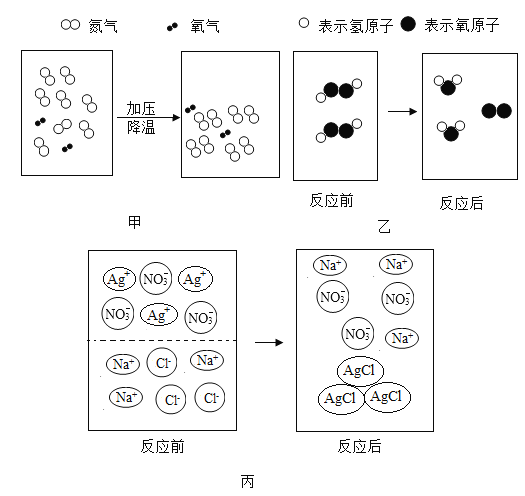
��Ŀ����
����Ŀ��ˮ����������ͻ�ѧʵ��������ʮ����Ҫ������ ������ˮ������ˮ�Ĺ���Ϊȡˮ���������������������������ھ�ˮ�����г��ø������(K2FeO4)����������
(1)�Ʊ�K2FeO4�Ļ�ѧ����ʽΪ2Fe(OH)3+3Cl2+10KOH�T2K2FeO4+6X+8H2O����X�Ļ�ѧʽΪ____��K2FeO4����Ԫ�صĻ��ϼ�Ϊ________��
(2)����ˮ���ľ�ˮ�����У�������Ϊ�˳�ȥˮ�е�________���ʣ�
(3)����֤��һƿ��ɫ��Һ���Ǵ�ˮ���ɿ���ʵ�鷽����______(ѡ����ĸ)
A 1.01��105Paʱ�е�Ϊ100��
B �����pH=7
C ���ʱ�õ�H2��O2�������Ϊ2��1
(4)���������ͼʵ�������������ܽ�����ش���������(���мס��ҡ����������ᾧˮ)

��д����ʯ����ˮ��Ӧ�Ļ�ѧ����ʽ________���Թ�����ʢ������Һ������Ϊ��Ӧ�ܽ�������е�________(ѡ����������������������)��
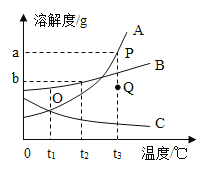
�����Ҫ������ͬŨ�ȵļס��ұ�����Һ����Ҫ���¶ȿ�����________�森
��t3��ʱ�����������ļס��ҡ����ı�����Һ(û��ʣ�����)�����µ�t1�棬��Һ�����ʵ�����������С�����˳��Ϊ________��
���𰸡�KCl +6 ������ A CaO+H2O=Ca(OH)2 �� t2 �����ף���
��������
���������غ㶨�ɣ��Ⱥ����߸�ԭ�ӵ��������Ŀ��ȣ�2Fe(OH)3+3Cl2+10KOH�T2K2FeO4+6X+8H2O����X���Ȼ��أ���K2FeO4����Ԫ�صĻ��ϼ�Ϊx��(+1)��2+x+(��2)��4=0��x=+6������ˮ���ľ�ˮ�����У�������Ϊ�˳�ȥˮ�еIJ��������ʣ���Ϊ��(1)KCl��+6��
(2)�����ԣ�
����֤��һƿ��ɫ��Һ���Ǵ�ˮ���ɿ���ʵ�鷽��������1.01��105Paʱ�е�Ϊ100�棻�ʴ�Ϊ��A��
����ʯ����ˮ��Ӧ������ʯ�ң��Թ�����ʢ������Һ������Ϊ��Ӧ�ܽ�������еı�����Ϊ��ʯ�Һ�ˮ��Ӧ���ȣ������ܽ�����¶ȵ����߶����٣���t2��ʱ���ס��ҵ��ܽ����ȣ���������ͬŨ�ȵļס��ұ�����Һ��t3��ʱ�����������ļס��ҡ����ı�����Һ(û��ʣ�����)�����µ�t1�棬��Һ�����ʵ�����������С�����˳��Ϊ�����ף��ң���Ϊ���º��ҵ��ܽ�ȴ��ڼף����ɱ�����Һ��Ϊ��������Һ��������С���ʴ�Ϊ����CaO+H2O=Ca(OH)2��������t2���۱����ף��ҡ�

����Ŀ��Ϊ̽����Ļ�ѧ���ʣ�ij��ѧС�������������������ʵ���������ش�
ʵ�� |
A |
B |
C |
D |
E |
��1��A�Թ��е�ʵ������Ϊ___��д��ͼ��C��Ӧ�Ļ�ѧ����ʽ____��
��2������Ӧ��D��E�Թ��еķ�Һ����һ���ྻ���ձ��У��۲쵽�ձ����������ݲ��������а�ɫ�������֡����ձ��еĻ������ˣ��õ���ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�����ʵijɷֽ�������̽����
��������⣩��Һ�����ʵijɷ���ʲô��
���������룩
����һ��NaCl
�������NaCl��BaCl2
��������NaCl��BaCl2��Na2CO3
�����ģ�____��
���������ۣ��������ۣ�ͬѧ��һ����Ϊ�������Ǵ����.���û�ѧ����ʽ����������ԭ��_____________________��
�����ʵ�飩�����ʵ�鱨�档
ʵ�鲽�� | ʵ������ | ʵ����� |
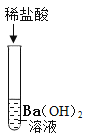
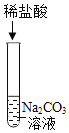
ȡ������Һ���Թ��У��μ�������̼������Һ | ���������� | ����������� |
ȡ������Һ���Թ��У��μ�ϡ���� | ___ | �����ij��� |
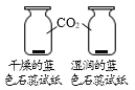
����˼��չ���ڷ�����Ӧ���������ʵijɷ�ʱ����������������迼��___��
����Ŀ�����Ʊ�����ʵ��̽������Ҫ����������ʵ����������ﵽʵ��Ŀ�ĵ��ǣ�������
|
|
|
|
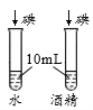
A��̽������þ�������ǿ�� | B��̽��������̼��ˮ�Ƿ�����Ӧ | C��̽����ͬ�ܼ��������ܽ��Դ�С | D��̽���¶ȶԷ����˶�������Ӱ�� |
A. AB. BC. CD. D