题目内容
(2009?宣武区一模)自然界中人与动物的生存都离不开氧气.(1)核潜艇舱室中氧气的来源主要靠电解水制得(原理如图).
①正极收集的气体是,
②A试管和B试管中收集到的气体的体积比约等于,
③水是由组成的.
(2)过氧化钠(Na2O2)可作为宇航员供氧剂.它与人体呼出的二氧化碳气体反应生成氧气和另一种能用于造纸、纺织等生产的物质,这种物质的俗名为.
(3)亚氯酸钠(NaClO2)不仅可以制得氧气,还可用于漂白杀菌,其中氯元素的化合价为.
(4)过氧化钙(CaO2)用于鱼池供氧剂,同时有熟石灰生成.
①写出过氧化钙与水反应的化学方程式.
②现将7.2g过氧化钙放入36.0g水中,使之充分反应,所得混合物中氧元素的质量分数(结果保留一位小数).

【答案】分析:(1)水在通电条件下分解生成氢气和氧气,与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;
(2)根据反应物和生成物,利用元素守恒结合用途来分析.
(3)根据化合物中正负元素化合价代数和为零,由亚氯酸钠中钠元素为+1价、氧元素为-2价可计算氯元素的化合价
(4)①根据题干中所给的反应物和生成物,结合化学方程式的书写要求进行解答.
②可根据化合物中元素的质量分数计算出过氧化钙和水中氧元素的质量,然后化学方程式求出放出氧气的质量,然后根据质量守恒定律求出反应后溶液的总质量,进而解出所得混合物中氧元素的质量分数.
解答:解:(1)水在通电条件下分解生成氢气和氧气,2H2O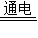 2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.
2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.
故答案为:①氧气;②2:1;③氢、氧两种元素
(2)根据反应物为Na2O2和CO2,生成物有O2,根据元素守恒,可知生成物中含有碳和钠元素,结合用途可猜想出为碳酸钠,俗名纯碱或苏打.
故答案为:纯碱(或苏打)
(3)根据化合物中正负元素化合价代数和为零,由亚氯酸钠中钠元素为+1价、氧元素为-2价,设氯元素化合价为x,
(+1)×1+X+(-2)×2=O
解之得x=+3价;
故答案为:+3
(4)①根据题干可知反应物为过氧化钙和水,生成物氢氧化钙和氧气,根据质量守恒定律配平可得方程式.
故答案为:2CaO2+2H2O=2Ca(OH)2+O2↑
②7.2g过氧化钙中氧元素的质量为:7.2g×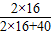 ×100%=3.2g
×100%=3.2g
36.0g水中所含氧元素的质量为:36g×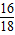 ×100%=32g
×100%=32g
设过氧化钙和水反应生成氧气的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
7.2g x
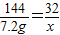
解之得:x=1.6g
所以反应后所得混合物的质量为7.2g+36g-1.6g=41.6g
所得混合物中氧元素的质量为3.2g+32g-1.6g=33.6g
故所得混合物中氧元素的质量分数为: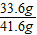 ×100%=80.8%
×100%=80.8%
故答案为:80.8%
点评:本题是一道综合性试题,以氧气的制备和用途考查了电解水实验及化学方程式的书写和根据化学方程式进行计算的多方面知识.
(2)根据反应物和生成物,利用元素守恒结合用途来分析.
(3)根据化合物中正负元素化合价代数和为零,由亚氯酸钠中钠元素为+1价、氧元素为-2价可计算氯元素的化合价
(4)①根据题干中所给的反应物和生成物,结合化学方程式的书写要求进行解答.
②可根据化合物中元素的质量分数计算出过氧化钙和水中氧元素的质量,然后化学方程式求出放出氧气的质量,然后根据质量守恒定律求出反应后溶液的总质量,进而解出所得混合物中氧元素的质量分数.
解答:解:(1)水在通电条件下分解生成氢气和氧气,2H2O
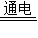 2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.
2H2↑+O2↑;与电源正极相连的一端产生的气体为氧气,与电源负极相连的一端产生的气体为氢气,两种气体体积比约为1:2;通过此实验可以证明水是由氢、氧两种元素组成.故答案为:①氧气;②2:1;③氢、氧两种元素
(2)根据反应物为Na2O2和CO2,生成物有O2,根据元素守恒,可知生成物中含有碳和钠元素,结合用途可猜想出为碳酸钠,俗名纯碱或苏打.
故答案为:纯碱(或苏打)
(3)根据化合物中正负元素化合价代数和为零,由亚氯酸钠中钠元素为+1价、氧元素为-2价,设氯元素化合价为x,
(+1)×1+X+(-2)×2=O
解之得x=+3价;
故答案为:+3
(4)①根据题干可知反应物为过氧化钙和水,生成物氢氧化钙和氧气,根据质量守恒定律配平可得方程式.
故答案为:2CaO2+2H2O=2Ca(OH)2+O2↑
②7.2g过氧化钙中氧元素的质量为:7.2g×
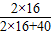 ×100%=3.2g
×100%=3.2g36.0g水中所含氧元素的质量为:36g×
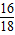 ×100%=32g
×100%=32g设过氧化钙和水反应生成氧气的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
7.2g x
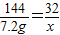
解之得:x=1.6g
所以反应后所得混合物的质量为7.2g+36g-1.6g=41.6g
所得混合物中氧元素的质量为3.2g+32g-1.6g=33.6g
故所得混合物中氧元素的质量分数为:
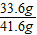 ×100%=80.8%
×100%=80.8%故答案为:80.8%
点评:本题是一道综合性试题,以氧气的制备和用途考查了电解水实验及化学方程式的书写和根据化学方程式进行计算的多方面知识.

练习册系列答案
相关题目
(2009?宣武区一模)浴室喷头长时间使用会有白色固体附着,这是因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[Ca(HCO3)2]受热易分解,生成难溶性的化合物、气体等物质.某小组探究碳酸氢钙受热分解后产物的成分.
【提出猜想】从组成物质元素的角度分析:
猜想1.生成的难溶性化合物可能是碳酸钙.
猜想2.放出的气体可能是CO2、______、______等.
【方案设计】请你设计实验,帮助该组同学确定难溶物的成分.
【实验探究】该组同学设计如下实验,继续探究气体的成分.
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊.
操作2.在a处用燃着的木条检验,无明显现象.

【实验结论】
结论1.碳酸氢钙分解产生的气体一定有CO2;一定没有______.
结论2.碳酸氢钙受热分解的化学方程式为Ca(HCO3)2 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
【实验交流】
交流1.从安全的角度考虑,实验操作2中存在的不足是______.
交流2.小组内某同学对上述结论提出异议:
【提出猜想】从组成物质元素的角度分析:
猜想1.生成的难溶性化合物可能是碳酸钙.
猜想2.放出的气体可能是CO2、______、______等.
【方案设计】请你设计实验,帮助该组同学确定难溶物的成分.
| 实验步骤 | 实验现象和结论 |
| ______ | ______: 则证明难溶物为碳酸钙 |
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊.
操作2.在a处用燃着的木条检验,无明显现象.

【实验结论】
结论1.碳酸氢钙分解产生的气体一定有CO2;一定没有______.
结论2.碳酸氢钙受热分解的化学方程式为Ca(HCO3)2
 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O【实验交流】
交流1.从安全的角度考虑,实验操作2中存在的不足是______.
交流2.小组内某同学对上述结论提出异议:
| 该同学的观点 | 请说出你的观点并阐述理由 |
| 该实验没有对氧气进行验证 | |
| “结论2”不正确 |
 (2009?宣武区一模)A~G是初中化学常见的七种物质.“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)
(2009?宣武区一模)A~G是初中化学常见的七种物质.“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)