题目内容
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
(提出问题)①三种溶液的酸碱性?②它们与酸反应时溶液的pH如何变化?
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
(实验1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液 显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
(实验2)向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
(实验3)向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。
(解释与结论)
(1)实验l得出三种溶液的碱性由强到弱的顺序为_____。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_____________。
(3)实验3中,b点的溶质为_______(填化学式),c点后发生反应的化学方程式为_________。
(4)依据实验
(拓展与延伸)洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215. 6g。试计算下列问题:
已知:洁厕灵有效成分是HCl,洁厕灵中其他成分均不跟NaHCO3反应。
(1)该品牌洁厕灵中HCl的质量分数是____?(写出计算过程)
(2)该实验中,你认为NaHCO3溶液加入“足量”对测定结果____(填“有”或“无”)影响。
【答案】氢氧化钠>碳酸钠>碳酸氢钠 溶液pH由大于7变成小于7 溶液变为紫红色 NaCl、HCl NaHCO3+HCl=NaCl+H2O+CO2↑ 取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠 3.65% 无
【解析】
[解释与结论]
(1)碳酸氢钠溶液中显示的是蓝色,pH为8~9,碳酸钠溶液中显示的是绿色,pH为10~11,氢氧化钠溶液中为黄色,pH为12~14,故三种溶液的碱性由强到弱的顺序为氢氧化钠>碳酸钠>碳酸氢钠,故填:氢氧化钠>碳酸钠>碳酸氢钠。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是溶液pH由大于7变成小于7,说明氢氧化钠已经完全反应;实验结束,向反应后的溶液中滴加紫甘蓝汁液,由于溶液pH在2~3左右,观察到的现象是溶液变为紫红色。
故填:溶液pH由大于7变成小于7;溶液变为紫红色。
(3)实验3中,b点的溶质有碳酸氢钠和盐酸反应生成的氯化钠和过量的盐酸中的氯化氢;
由图可知将图2与图3的阴影部分进行叠加,发现两者基本重合,说明c点后是碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑。
故填:NaCl、HCl;NaHCO3+HCl=NaCl+H2O+CO2↑。
(4)依据实验3获取的信息可知,向碳酸钠溶液中滴加稀盐酸时,稀盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、水和二氧化碳,因此鉴别Na2CO3和NaHCO3固体的实验方案为:取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。
故填:取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。
[拓展与延伸]
(1)解:根据质量守恒定律可得,生成的二氧化碳的质量为100g+120g-215.6g=4.4g
设该品牌洁厕灵中HCl的质量分数为x
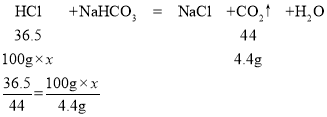
x=3.65%
答:该品牌洁厕灵中HCl的质量分数是3.65%。
故填:3.65%。
(2)该实验中,加入NaHCO3溶液足量是为了使稀盐酸完全反应,因此对测定结果无影响。
故填:无。

【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
[提出问题]瓶口白色固体的成分是什么?
[查找资料]
(1)玻璃中含有二氧化硅(SiO2) ,二氧化硅能与氢氧化钠溶液反应,生成硅酸钠(Na2SiO3) 和水。
(2)硅酸钠是一种白色固体,有很强的粘合性,可溶于水,溶液呈碱性:硅酸钠溶液能与强酸反应,如: ![]() (白色) :硅酸钠溶液能与氯化钙溶液反应:
(白色) :硅酸钠溶液能与氯化钙溶液反应: ![]() (白色)。
(白色)。
[作出猜想]白色固体的成分是:
猜想l:硅酸钠;
猜想2:硅酸钠和碳酸钠;
猜想3:硅酸钠、碳酸钠和氢氧化钠
[实验探究]取一定量白色固体溶于适量水中形成样品溶液,分别进行如下实验探究:
实验 | 实验操作 | 实验现象 | 结论与评价 |
实验一 | 取样品溶液少许于试管中,加入足量的稀盐酸 | 有气泡冒出且产生白色沉淀 | 猜想__不成立 |
实验二 | ①另取样品溶液少许于试管中,加入过量的氯化钙溶液 | ________________。 | 猜想3成立。 |
②取上述实验①后的上层清液,滴加____________ | 产生蓝色沉淀 |
写出实验二中产生蓝色沉淀的化学方程式:________________________。
[反思交流]
(1)氢氧化钠溶液必须密封保存,且试剂瓶只能用橡胶塞。
(2)实验二中过量的氯化钙溶液的作用是____________________。