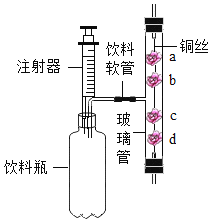
题目内容
【题目】金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
(实验目的)测定金属铁、铜和镁的活动性强弱。
(实验过程)
步骤Ⅰ 将铁片、铜片、镁片分别在空气中加热片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有浓度相同、体积相同的稀硫酸的试管中;
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有浓度相同、体积相同的硝酸银溶液的试管中。
(实验记录)用“×”表示实验无明显现象,用“√”表示实验有明显现象,(见表);
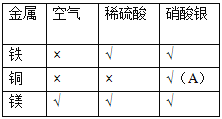
记录表A处应填写的现象是(1)________________,
该反应的化学方程式为(2)______________________。
(实验结论)由步骤Ⅰ和Ⅱ可判断金属铁、铜和镁的活动性由强到弱的顺序是(3)______________________;
(反思交流)小欣同学认为除了以上实验方案以外,在老师提供的药品中(金属已打磨):铁片、铜片、镁片、FeCl2溶液、CuCl2溶液、MgCl2溶液,只选三种药品也能达到实验目的,她选用的药品是(4)__________________________。(任写一种组合即可)
【答案】铜丝表面有银白色固体析出,溶液由无色变为蓝色 Cu+2AgNO3=Cu(NO3)2+2Ag Mg>Fe>Cu 镁片、FeCl2溶液、铜片 或 MgCl2溶液、铁片、CuCl2溶液
【解析】
实验记录:
(1)铜能和硝酸银溶液反应生成银和硝酸铜,所以观察到的现象是铜丝表面有银白色固体析出,溶液由无色变为蓝色,反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
实验结论:
在步骤Ⅰ中,镁片能够在空气中燃烧,说明镁比铁、铜活泼;在步骤Ⅱ中,铁能和稀硫酸反应,铜不能和稀硫酸反应,说明铁比铜活泼。金属铁、铜和镁的活动性由强到弱的顺序是Mg>Fe>Cu;
反思交流:
镁、铁、铜的金属活动性顺序是镁>铁>铜;在验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应,因此可选用MgCl2溶液、铁片、CuCl2溶液或镁片、FeCl2溶液、铜片。

【题目】全国人大和政协会议使用了一种含碳酸钙的“石头纸”。为测定其中碳酸钙(杂质不溶于水,也不与盐酸反应)的含量,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8g稀盐酸后并用电子天平称量,记录实验数据如表:
加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
烧杯及所称物质总质量/g | 82.2 | 101.9 | 121.6 | 141.3 | 162.1 |
(1)“石头纸”中碳酸钙的质量分数为_____
(2)求恰好完全反应时烧杯内溶液中溶质的质量分数____(写出计算过程)