题目内容
【题目】一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁(黑色)、铁。
实验一:某化学兴趣小组的同学设计了如图1所示的实验装置测定某赤铁矿样品中Fe2O3的质量分数。
他们称取10.0g赤铁矿,当赤钛矿中的Fe2O3全部还原为Fe时,剩余固体在CO的保护下冷却、称量,质量为7.6g(假设赤铁矿中的杂质均不与CO反应)。

(1)实验过程中可观察到的现象是_____;
(2)实验结束时继续通入一氧化碳的目的是_____;
(3)该赤铁矿中Fe2O3的质量分数为______;
实验二:在钢铁厂的实验室,同学们采集了用某种热分析仪记录的CO与Fe2O3进行反应时的有关数据,并得到固体质量与反应温度的关系曲线,如图2所示:
(4)根据图象分析写出P点时固体成分的化学式_____;
(5)固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为_____。
【答案】红色粉末变为黑色,澄清石灰水变浑浊 防止生成的铁被空气中的氧气氧化 80% Fe 3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
【解析】
(1)一氧化碳和氧化铁反应生成铁和二氧化碳,所以图中玻璃管处实验现象是红色粉末变为黑色,二氧化碳能使澄清石灰水变浑浊,试管处实验现象是澄清石灰水变浑浊.故填:红色粉末变为黑色,澄清石灰水变浑浊;
(2)实验结束后继续通入一氧化碳到玻璃管冷却,目的是防止生成的铁被空气中的氧气氧化;故填:防止生成的铁被空气中的氧气氧化;
(3)设该赤铁矿中Fe2O3的质量为x
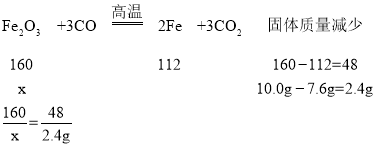
x=8g
该赤铁矿中Fe2O3的质量分数为![]() ×100%=80%;故填:80%;
×100%=80%;故填:80%;
(4)氧化铁中氧元素质量为![]() ,铁元素质量=48-14.4g=33.6g,,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe。故填:Fe;
,铁元素质量=48-14.4g=33.6g,,根据图象曲线可知,加热到800℃时三种氧化物反应完全,此时固体为Fe。故填:Fe;
(5)固体质量由48.0g变为46.4g时,对应温度为400-500℃,此时Fe2O3与CO反应,失去氧元素的质量为48g-46.4=1.6g,氧化铁中氧元素质量为![]() ,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁、氧原子个数比=
,铁元素质量=48-14.4g=33.6g,残余固体中氧元素质量=14.4g-1.6g=12.8g,铁、氧原子个数比=![]() =3:4,所以此时还原产物为Fe3O4。对应方程式为3Fe2O3+CO
=3:4,所以此时还原产物为Fe3O4。对应方程式为3Fe2O3+CO![]() 2Fe3O4+CO2。
2Fe3O4+CO2。
故填:3Fe2O3+CO![]() 2Fe3O4+CO2。
2Fe3O4+CO2。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案