题目内容
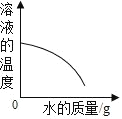
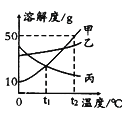
【题目】卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl 等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关 物质的溶解度曲线(如图所示)回答下列问题:
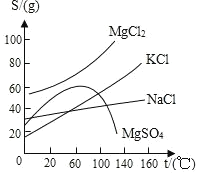
(1)将卤水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体.这时得到的晶体的主要成分是_______.
(2)过滤出上述晶体后,将滤液降温到30℃以下,还会逐渐析出晶体.这时得到的晶体的主要成分是_______.
(3)将第(2)步操作得到的晶体用一定量的冷水洗涤,最后可以得到比较纯净 的_______晶体.
【答案】NaCl和MgSO4 MgCl2和KCl KCl
【解析】
(1)观察溶解度图象,当温度大于60℃,随着温度的升高,MgSO4的溶解度反而下降,NaCl的溶解度一直比较低.所以这两种物质就会结晶析出,故答案为:NaCl和MgSO4;
(2)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,MgCl2和KCl随着温度的降低而下降,故答案为:MgCl2和KCl;
(3)降温时析出晶体,说明该晶体溶解度随温度的降低而降低;从图象可以看出,在温度较低时,MgCl2的溶解度大于KCl的溶解度;所以冷水洗涤时较纯的KCl固体就会析出.低于30℃时,MgCl2的溶解度大于KCl的溶解度,所以,用少量冷水淋洗析出的晶体,就得到较纯的KCl晶体.故答案为:KCl.

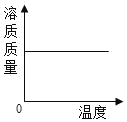
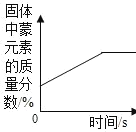
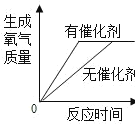
【题目】下列实验所对应的四个图象中,不正确的是( )
|
|
|
|
A向 NaOH 溶液滴加足量的水 | B将一定质量硝酸钾和饱和溶液升高 温度 | C加热 KClO3,MnO2混合物 | D完全相同的过氧化氢溶液制取 氧气 |
A.AB.BC.CD.D
【题目】请完成下列实验,回答问题。
某同学将氢气与空气混合,在安全保障下在老师指导下点燃,实验如下
V(H2)/V(空气) | 1:99 | 3:97 | 4:96 | 50:50 | 70:30 | 75:25 |
点火 | 不炸 | 不炸 | 炸 | 炸 | 炸 | 不炸 |
(1)该实验说明氢气的爆炸极限范围可能为_____~_____之间(用百分数表示)
(2)鉴于该实验爆炸的危险性,说明点燃氢气前必须验纯,验纯的操作为_____。
(3)该实验证明水是由_____组成的。