题目内容
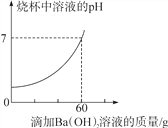
【题目】某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量。取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH值变化的部分数据如表和图所示:(已知BaCl2溶液的pH=7)
滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 | 30 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |
求:(1)完全反应后生成沉淀的质量为________。
(2)计算该洁厕灵溶液中HCl的质量分数为___________?(计算结果保留至0.1%)
【答案】 4.66g 14.6%
【解析】(1)硫酸与氯化钡反应生成沉淀,而盐酸与氯化钡反应不生成沉淀,所以利用沉淀可计算硫酸消耗氢氧化钡的量,沉淀为4.66g后,质量不再增加,说明此时硫酸已经完全反应;氢氧化钡的总量减硫酸消耗的氢氧化钡就得到盐酸消耗的氢氧化钡,然后再计算氯化氢的质量。
(2)解:设与H2SO4反应的Ba(OH)2质量为x。
Ba(OH)2+H2SO4===BaSO4↓+2H2O
171 233
x 4.66g
![]() x=3.42g
x=3.42g
则与H2SO4反应的Ba(OH)2溶液质量为![]() =20g。
=20g。
由题意可知:与HCl完全反应的Ba(OH)2溶液的质量为60g-20g=40g。
设20g该品牌洁厕灵溶液中HCl的质量为y。
Ba(OH)2+2HCl===BaCl2+2H2O
171 73
40g×17.1% y ![]() y=2.92g
y=2.92g
20g该品牌洁厕灵溶液中HCl的质量分数为![]() ×100%=14.6%。
×100%=14.6%。
答:20g该品牌洁厕灵溶液中HCl的质量分数为14.6%。

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目