题目内容
【题目】有一包不纯的碳酸钾粉末,所含杂质可能是硝酸钾、硝酸钙、氯化钾、氯化亚铁、碳酸钠中的一种或几种。为确定其成分,进行如下实验:
①取少量该粉末于试管中,加足量的水充分溶解,得到无色澄清溶液。向该溶液中加入适量的硝酸银溶液,有白色沉淀产生,再加入足量的稀硝酸,充分反应后,部分白色沉淀消失。
②另取13.8g该粉末于烧杯中,加水使其完全溶解,再加入200g一定溶质质量分数的氯化钡溶液,恰好完全反应,过滤后得到19.7g白色沉淀和滤液a。
下列说法正确的
A. 杂质中一定含有氯化钾,可能含有硝酸钾、碳酸钠
B. 该包粉末的组成只有两种情况
C. 滤液a中所含氯元素质量一定大于7.1g
D. 所用氯化钡溶液中溶质的质量分数为20.8%
【答案】BC
【解析】
①氯化亚铁溶于水溶液呈浅绿色,得到无色澄清溶液,说明粉末中一定不含氯化亚铁和硝酸钙;加入适量的硝酸银溶液,硝酸银能和氯离子反应生成难溶于水且难溶于稀硝酸的白色沉淀氯化银,还能和碳酸根离子反应生成白色沉淀碳酸银,碳酸银难溶于水可溶于酸,根据加入足量的稀硝酸后,部分白色沉淀消失说明粉末中一定含有氯化钾和碳酸钠;由上分析可知样品碳酸钾粉末中一定含有杂质碳酸钠、氯化钾,一定不含氯化亚铁,可能含有硝酸钾;
②根据生成沉淀碳酸钡的质量为19.7g, ![]() ,
,![]() ,再根据方程式中BaCl2~BaCO3的质量比可知,设生成19.7g碳酸钡沉淀消耗氯化钡的质量为x。
,再根据方程式中BaCl2~BaCO3的质量比可知,设生成19.7g碳酸钡沉淀消耗氯化钡的质量为x。
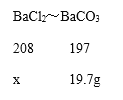
x=20.8g,则所用氯化钡溶液中溶质的质量分数=![]() ×100%=10.4%,氯化钡中含有的氯元素质量=20.8g×
×100%=10.4%,氯化钡中含有的氯元素质量=20.8g×![]() ×100%=7.1g,又因为粉末中一定含有氯化钾,所以滤液a中所含氯元素质量一定大于7.1g。
×100%=7.1g,又因为粉末中一定含有氯化钾,所以滤液a中所含氯元素质量一定大于7.1g。
A、由上分析可知,杂质中一定含有氯化钾、碳酸钠,可能含有硝酸钾,故选项不正确;
B、由上分析可知,该包粉末的组成只有两种情况,一是碳酸钾和碳酸钠和氯化钾和硝酸钾,二是碳酸钾和碳酸钠和氯化钾,故选项正确;
C、由上分析可知,滤液a中所含氯元素质量一定大于7.1g,故选项正确;
D、由上分析可知,所用氯化钡溶液中溶质的质量分数为10.4%,故选项不正确;
故选BC。

 名校课堂系列答案
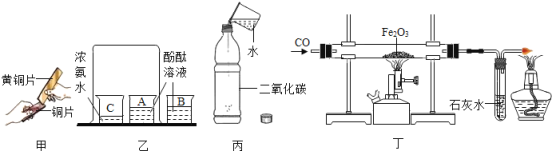
名校课堂系列答案【题目】⑴水是生命的源泉,也是不可缺少的资源。
①自然界的水常遭到污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指____;(填字母)
A.元素 B.原子 C.离子 D.分子
②生活中,既能降低水的硬度,又能杀菌消毒的方法是______。
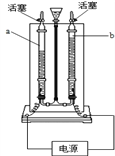
③电解水的装置如下图所示,管A、管B中的气体的质量比是______,在电解水的过程中,保持不变的粒子是____ 。
⑵多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
①根据下表提供的信息,填写有关含碳物质的对应特性。
物质用途 | 金刚石切割玻璃 | 活性炭净水 |
对应特性 | __ | __ |
②二氧化碳是一种宝贵的资源。固定和利用二氧化碳的一个成功范例是:CO2+2M===CO(NH2)2+H2O,物质M的化学式为_________。
③目前,人类以化石燃料为主要能源。化石燃料有煤、石油和____,石油主要含有____元素。
⑶铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。
①按人类开始使用这三种金属的先后排序为_____(用元素符号表示)。
②在空气中______制品(填“铝”或“铁”)更耐腐蚀。
③用铝和一种化合物的溶液来证明铝和铁的金属活动性强弱,你认为该化合物可以是_______(填化学式)。