题目内容
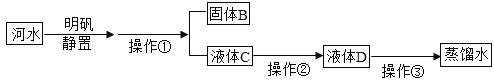
【题目】利用能源、节约能源、保护环境是我们大家共同关注的社会问题。某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示:
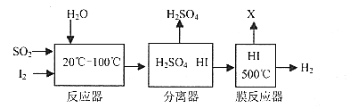
(1)写出反应器中发生化学反应的方程式____________________。
(2)此制备过程中可循环利用的物质是__________。
(3)硫酸用途广泛,汽车铅酸蓄电池中含有硫酸,其中需要用到溶质质量分数为24.5%的硫酸溶液。
①同学们在实验室用浓硫酸配制稀硫酸,除用到胶头滴管、量筒、烧杯外,还需要用到的仪器有___________。
②实验室用98%的浓硫酸(密度1.84g/mL)配制24.5%的硫酸溶液1200g,需要98%浓硫酸的体积为________mL(计算结果保留至0.1)。
【答案】SO2+I2+2H2O![]() H2SO4+2HI I2 玻璃棒 163.0
H2SO4+2HI I2 玻璃棒 163.0
【解析】
(1)有题意可知反应器中发生反应的反应物是二氧化硫、水和碘单质,生成物是硫酸和碘化氢,反应条件是20℃—100℃,通过观察法即可配平方程式,方程式故填SO2+I2+2H2O ![]() H2SO4+2HI;
H2SO4+2HI;
(2)根据质量守恒定律中的元素守恒可知,在膜反应器中发生碘化氢分解生成碘单质和氢气,分离出的物质X为碘单质,又能投入到反应器中进行再利用,可循环利用的物质故填I2;
(3)①同学们在实验室用浓硫酸配制稀硫酸,需要经过计算、量取、溶解、转移四个步骤,其中量取需要用到胶头滴管和量筒,溶解需要用到烧杯和玻璃棒,故填玻璃棒;
②假设需要98%浓硫酸的体积为V,根据稀释前后溶液中溶质质量不变,可知1.84g/mL· V·98%=24.5%×1200g,解得V≈163.0mL,故填163.0。

 小学课时特训系列答案
小学课时特训系列答案【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】(探究一)利用如图所示的实验装置制备常见气体,请回答有关问题:
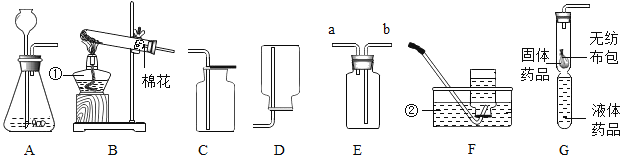
(1)写出标有序号的仪器名称:①_____.②_____.
(2)装置B为气体发生装置,在试管内放入一种暗紫色固体粉末制取氧气以制取氧气,写出有关反应的化学方程式_____.收集装置为_____.
(3)用装置E收集氧气,验满时将带火星的木条放在_____ (选填“a”或“b”)处.
(4)装置G是用软塑料管自制的气体发生装置,利用该装置也可以制取氧气,塑料管中加入的液体药品是_____,药品加入完毕后,要使反应进行,接下来的操作是:_____.
(探究二)探究氧化铁是否像二氧化锰一样可作氯酸钾分解的催化剂同学们设计了三组实验(其他可能影响因素均控制相同):
实验编号 | 实验药品 | 分解温度(℃) |
实验④ | 1.2g KClO3 | T1 |
实验⑤ | 1.2g KClO3、0.5g MnO2 | T2 |
实验⑥ | 1.2g KClO3、0.5g Fe2O3 | T3 |
(1)请写出氯酸钾在二氧化锰催化下制取氧气的化学方程式:_____
(2)若T3_____ (选填“>”、“=”或“<”)T1,说明氧化铁能加快氯酸钾的分解.
(3)若要比较氧化铁与二氧化锰对氯酸钾分解的催化效果,除了可以通过用比较T3与T2的大小,还可以通过排水法收集氧气,测量_____ 进行比较,得出结论.