题目内容
【题目】小红同学进行酸碱中和反应的实验(如图所示).她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化.于是她对烧杯中的溶液进行了以下探究: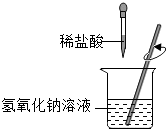
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量.
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证.请根据相关内容填写如表:
试验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中. | 如果 | 则盐酸过量 |
如果 | 则盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的.你认为其中不正确的是 (填序号).
A.生锈的铁钉
B.碳酸钠粉末
C.硫酸钠粉末
D.氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是(填序号).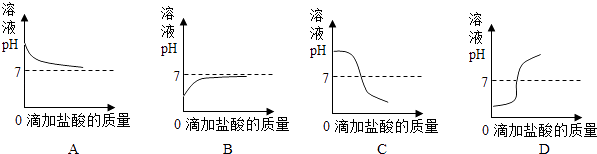
【答案】
(1)观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余
(2)有气泡冒出;没有气体生成
(3)C
(4)C
【解析】解:(1)向试管中滴加几滴无色酚酞试液,震荡,观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;(2)将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中.如果有气泡冒出,则盐酸过量;如果没有气体生成,则盐酸与氢氧化钠恰好完全反应;(3)A、酸能与生锈的铁钉反应;B、碳酸钠粉末与酸反应产生二氧化碳气体;C、硫酸钠粉末与酸不反应;D、氢氧化铜与盐酸反应产生氯化铜和水.(4)氢氧化钠溶液的pH>7,向氢氧化钠溶液中滴加一定量稀盐酸后,碱性减弱,盐酸过量,溶液的pH<7.答案:(1)观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;(2)
试验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中. | 如果 有气泡冒出 | 则盐酸过量 |
如果 没有气体生成 | 则盐酸与氢氧化钠恰好完全反应 |
3)C;(4)C.
(1)根据氢氧化钠溶液显碱性,能使酚酞试液变红色解答;(2)根据酸可以和活泼金属反应产生气泡设计实验;(3)根据酸的化学性质进行分析解答;(4)根据氢氧化钠溶液的pH>7,向氢氧化钠溶液中滴加一定量稀盐酸后,碱性减弱,盐酸过量,溶液的pH<7解答.

 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
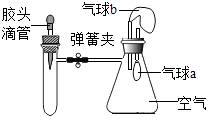
优翼小帮手同步口算系列答案【题目】如图所示,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是( )
试管内物质 | 胶头滴管内物质 | |
A | 氢氧化钠固体 | 水 |
B | 氧化钙 | 水 |
C | 浓硫酸 | 水 |
D | 二氧化碳 | 氢氧化钠溶液 |
A.A
B.B
C.C
D.D