题目内容
【题目】钠及其化合物是中学化学学习和研究的重要内容。
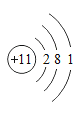
(1)如图是钠的原子结构示意图。下列说法不正确的是_____。
a、钠属于金属元素
b、钠原子的质子数为11
c、钠离子的符号为Na+
d、钠在化学反应中易得到电子
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为_____;小苏打受热分解成碳酸钠、二氧化碳和水,化学方程式为_____。
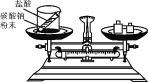
(3)配制一瓶如图溶液需氯化钠_____g;配制50g6%氯化钠溶液,若用量筒量取水时俯视读数(其他操作正确),则溶液的质量分数_____6%(填“>”、“<”或“=”)。

(4)已知![]() ;
;![]() 。实验室敞口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水,可观察到什么现象_____?写出过氧化钠的一种用途_____。
。实验室敞口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,加足量水,可观察到什么现象_____?写出过氧化钠的一种用途_____。
(5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若用该方法制取2.4kg钛,理论上需要钠的质量是多少?_____
【答案】d ![]()
![]() 4.5 > 固体溶解,有气泡产生 供氧剂 4.6kg
4.5 > 固体溶解,有气泡产生 供氧剂 4.6kg
【解析】
(1)a、钠元素含有“钅”,属于金属元素。a正确;
b、由图示可知,钠原子的质子数为11。b正确;
c、由图示可知,钠原子在化学反应中容易失去一个电子,形成钠离子,钠离子带了一个单位的正电荷,其符号为Na+。c正确;
d、由图示可知,钠原子的最外层电子数为1,小于4,在化学反应中容易失去一个电子,形成8电子的稳定结构。d错误。
故答案为:d;
(2)根据题意可知,钠和水在常温下混合即可生成氢氧化钠和氢气,该反应的化学方程式为:![]() ;
;
小苏打是碳酸氢钠的俗称,碳酸氢钠在加热的条件下易分解为碳酸钠、水和二氧化碳。故答案为:![]() ;
;
(3)需要称量氯化钠的质量为:500mL×1.0g/cm3×0.9%=4.5g。若使用量筒时俯视量取水,则会导致量取的水的体积偏小,则溶质的质量不变,溶液的质量减小,则溶质的质量分数偏大。故答案为:4.5、>;
(4)实验室敞口放置的过氧化钠已经部分变质,则向其中加入少量的水,未变质的过氧化钠会和水反应生成氢氧化钠和氧气,则能观察到溶液中有气泡产生。变质了的过氧化钠转化为碳酸钠,碳酸钠溶于水。则能观察到的现象是:固体全部溶解,溶液中有气泡产生。由于过氧化钠和水反应能生成氧气,则过氧化钠可以用做供氧剂。故答案为:固体溶解,有气泡产生、供氧剂;
(5)设理论上需要钠的质量是x
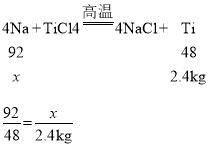
解得x=4.6kg
答:理论上需要钠的质量为4.6kg。

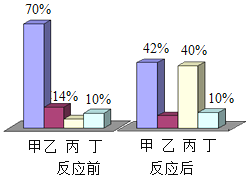
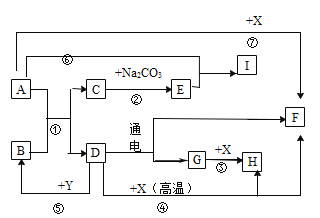
【题目】图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是( )

① | ② | ③ | ④ | ⑤ | ⑥ | |
A | CO2 | NaOH溶液 | 稀HCl溶液 | Ca(OH)2溶液 | CuCl2溶液 | Fe |
B | CaO | 稀HCl溶液 | Fe | 稀H2SO4溶液 | Na2CO3溶液 | Ca(OH)2溶液 |
C | Fe | 稀H2SO4溶液 | BaCl2溶液 | Cu(NO3)2溶液 | Ca(OH)2溶液 | Na2CO3溶液 |
D | Zn | 稀HCl溶液 | CaCO3 | CuSO4溶液 | NaOH溶液 | FeCl3溶液 |
A.AB.