��Ŀ����
����Ŀ��ij��ȤС��Ϊ�˲ⶨijƷ�Ƶķ��ͷ���̼����(�����ɷ�Ϊ�Ȼ���)��������������ȡ6�˷��ͷ����ڴ��Թ��У�Ȼ������Ȼ�����Һ�������ã��ټ����Ȼ�����Һ���������ϲ������������ٲ���Ϊֹ�����ˡ�ϴ�ӡ���ɣ��Ƶù�������Ϊ5�ˣ���ش��������⣺

(1)���˲���ʱ�����貣����������ͷ�ιܡ����������ձ����Ҫ______��
(2)���㷢�ͷ���̼���Ƶ���������______��
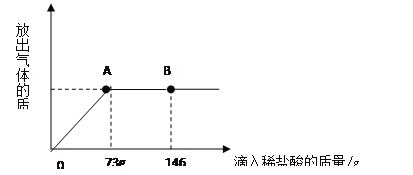
(3)��ͬѧ��Ϊ�˷������ڲ������ӡ����������ȱ�㣬�����������ͼʵ��ⶨ̼���Ƶ�������������������ʵ�����ݼ���ó�ʹ̼����ǡ����ȫ��Ӧ����Ҫ��������Һ������Ϊ49�ˡ���ʵ�ʲ�����a����ֵӦȡ______49��(ѡ������������������������С����)
���𰸡�©�� 88.3% ����
��������
���˲�������Ҫ�õ�©���Ȳ���������
�跢�ͷ���̼���Ƶ���������Ϊx
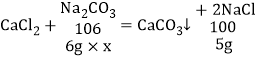
![]() ��x��88.3%
��x��88.3%
��������ʵ�����ݼ���ó�ʹ̼����ǡ����ȫ��Ӧ����Ҫ��������Һ������Ϊ49�ˡ���ʵ�ʲ�����������Ҫ��̼������ȫ��Ӧ����������Ҫ����������a����ֵӦȡ����49�ˡ�

��ϰ��ϵ�д�
�����Ŀ