题目内容
【题目】(6分)为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是______;
(2)发生反应的化学方程式为____________________________________________;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为__________;
(4)该黄铜样品中铜的质量分数是__________;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是__________;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是__________,再经过某些反应及操作就得到了所需铜盐。
【答案】(1) 40 g(l分)
(2)Zn+ 2HCl=ZnC12+ H2↑(1分)

(4)80%(1分) (5)13.6%(1分) (6)107 g(l分)
【解析】
试题分析:解:(1)根据溶液稀释前后溶质的质量不变,设需要质量分数为36.5%的浓盐酸的质量是X;
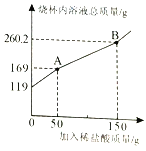
100g×14.6%=X×36.5%; 得x=40g;(2)在黄铜中金属锌与酸反应产生氢气;故(2)发生反应的化学方程式为Zn+ 2HCl=ZnC12+ H2↑;因为反应的减少的质量即为生成的氢气的质量,生成氢气的质量为:100g+100g-199.6g=0.4g;设金属锌的质量为X,生成氯化锌的质量为Y
Zn+ 2HCl=ZnC12+ H2↑,
65 136 2
X y 0.2g
65/2=x/0.4g 136/2=y/0.4g
x=13g y=27.2g
(3)黄铜样品中锌的质量(x)的比例式为:65/2=x/0.4g;(4)该黄铜样品中铜的质量分数是:(100g-13g-7g)/100g×100%=80%;(5)过滤后溶液的质量为:199.6g-87g+87.4g=200g;故最终所得溶液中溶质的质量分数是27.2g/200g×100%=13.6%;(6)过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,发生铜与氧气的反应,生成氧化铜;根据2Cu + O2 △ 2CuO
128 160
80g z
128/160=80g/z z=100g
所以得到固体混合物的质量为:100g+7g=107g