题目内容
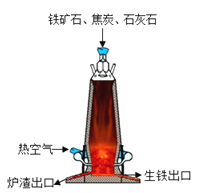
【题目】高纯氧化铁又称“引火铁”,可作催化剂,在现代工业上有广泛应用前景。以下是 用赤铁矿(含少量不溶于水的SiO2 等)为原料,制备高纯氧化铁的生产流程示意图。

查阅信息:(NH4)2CO3溶液呈碱性,40℃以上易分解。
(1)写出高温时赤铁矿中的Fe2O3与CO发生反应的化学方程式_____。
(2)①处发生反应的化学方程式为_____。
(3)加入(NH4)2CO3后,该反应必须控制的条件是____。
(4)加适量氨水的目的是____,以确保加入的(NH4)2CO3能顺利发生复分解反 应而生成FeCO3,则②处反应的化学方程式为_____。
(5)用蒸馏水洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志是:取最后 一次洗涤液,向其中加入适量的____
【答案】Fe2O3+3CO ![]() 2Fe+3CO2 Fe+ H2SO4 =FeSO4 + H2↑ 温度低于40℃ 除去酸,调节酸碱度 (NH4)2CO3+ FeSO4= FeCO3↓+(NH4)2SO4 BaCl2或Ba(NO3)2
2Fe+3CO2 Fe+ H2SO4 =FeSO4 + H2↑ 温度低于40℃ 除去酸,调节酸碱度 (NH4)2CO3+ FeSO4= FeCO3↓+(NH4)2SO4 BaCl2或Ba(NO3)2
【解析】
(1)Fe2O3与CO在高温的条件下反应生成铁和二氧化碳,反应的方程式为:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(2)①、①出是铁与稀硫酸反应生成硫酸亚铁和氢气,反应的方程式为:Fe+ H2SO4 =FeSO4 + H2↑
(3)(NH4)2CO3在40℃以上易分解,故该反应必须控制的条件是温度低于40℃。
(4)加适量氨水的目的是除去酸,调节酸碱度;②处是碳酸铵与硫酸亚铁反应生成碳酸铁和硫酸铵,反应的方程式为:(NH4)2CO3+ FeSO4= FeCO3↓+(NH4)2SO4
(5)FeCO3的表面附着由(NH4)2SO4,故检验是否清洗干净是将取最后 一次洗涤液,向其中加入适量的BaCl2或Ba(NO3)2,如没有沉淀出现,说明清洗干净。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】CO2通入NaOH溶液中没有明显现象,CO2与NaOH溶液是否发生了化学反应呢?某化学兴趣小组的同学对此进行了如下探究。
(查阅资料)
①通常情况下,1体积的水溶解1体积的CO2.②碳酸钡是种难溶于水的白色固体。
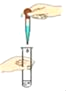
(实验探究)小红同学设计了如图所示的实验装置(锥形瓶内充满CO2),并利用该装置进行实验,打开玻璃塞和活塞,使NaOH溶液快速滴入锥形瓶中,再立即关闭活塞(漏斗中仍有溶液剩余),观察到U形管右侧的红墨水液面_____(选填“升高“降低”或“不移动”)。小红同学根据此现象判断出CO2和NaOH溶液发生了反应,理由是_____。
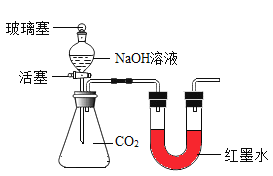
(反思与评价)小明同学认为小红同学的实验方案不严密,理由是_____。
(拓展实验)该兴趣小组的同学为此又设计了下表所示的两种实验方案做进一步的探究,请完成下列表格。
实验序号 | 实验方案 | 实验现象 | 结论 |
方案一 | 向通有二氧化碳的氢氧化钠溶液中滴加过量的_____(填试剂名称) | 最终有气泡产生 | CO2与NaOH溶液发生了反应,反应的化学方程式为_____ |
方案二 | 向通有二氧化碳的氢氧化钠溶液中滴加氢氧化钡溶液 | _____ |