题目内容
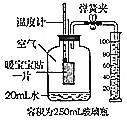
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴 趣小组的同学进行了如下实验,请你参与过程分析。

(查阅资料)
①草酸晶体在浓H2SO4作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
②碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳
③铁的常见氧化物中铁的质量分数:

称取铁红样品10.0g,用上述装置进行实验,测定铁红的质量分数。
(1)D中充分反应后得到Fe粉的质量为mg,则_______<m<_______。
(2)实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_______。
(实验评价)
(4)反思1:本实验中如果缺少F装置(不考虑其它因素),则测得样品中铁的质量分数会_____(填 “偏小”、“不变”或“偏大”)。
(5)反思2:请指出实验装置的一个明显缺陷_________。
(6)取出适量铁加入稀硫酸中恰好完全反应得到硫酸亚铁溶液,将一包由6.5克锌、4.8克镁、2.4克碳 混合而成的粉末,加入到此溶液中。实验结束后,测得剩余固体中含有三种物质。则剩余固体的质量可能是(___________)
A 19g B 21g C 20g D 19.2g
【答案】7.0 7.78 76.0% 偏小 缺少尾气处理装置或未检验水是否除尽 A
【解析】
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,氧化钙和水反应生成氢氧化钙,氢氧化钠和二氧化碳反应生成碳酸钠和水,一氧化碳和氧化铁反应生成铁和二氧化碳,样品中铁的质量分数等于样品中铁的质量除以样品的质量。
(1)根据铁红中三种铁的氧化物的含铁量,氧化铁中铁元素的质量分数最小,氧化亚铁中铁元素的质量分数最大,假设铁红中完全为氧化铁,则D中充分反应后得到铁粉的质量为
![]() ,假设铁红中完全为氧化亚铁,则D中充分反应后得到铁粉的质量为
,假设铁红中完全为氧化亚铁,则D中充分反应后得到铁粉的质量为
![]() ,D中充分反应后得到Fe粉的质量为mg,则7.0g<m<7.78g。
,D中充分反应后得到Fe粉的质量为mg,则7.0g<m<7.78g。
(2)实验前后称得E装置增重6.6g即为一氧化碳还原铁的氧化物后生成的二氧化碳的质量,由化学方程式即质量守恒定律可知,二氧化碳中氧元素有一半来自于铁的氧化物,质量为![]() ,则此铁红中铁的质量分数为
,则此铁红中铁的质量分数为![]() 。
。
(4)反思1:本实验中如果缺少F装置(不考虑其它因素),E装置会吸收空气中的水蒸气和二氧化碳,导致质量偏大,计算出的氧元素的质量偏大,导致测定样品中铁的质量分数偏小。
(5)反思2:实验装置的一个明显缺陷是缺少尾气处理装置或未检验水是否除尽。
(6)铁和稀硫酸反应生成硫酸亚铁和氢气,镁的金属活动性强于锌,锌强于铁,镁先和硫酸亚铁反应生成硫酸镁和铁,锌和硫酸亚铁反应生成硫酸锌和铁,碳不参与反应,实验结束后,测得剩余固体中含有三种物质,剩余固体中含有碳、铁,镁。
设6.5克锌完全反应生成铁的质量为x
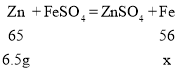
![]()
![]()
设4.8克镁完全反应生成的铁的质量为y
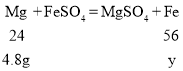
![]()
![]()
剩余固体的最大质量可能为![]() 。
。
故选A。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案