题目内容
【题目】在做酸碱中和反应的实验时,某同学向盛有NaOH溶液的烧杯中加入一定量的稀硫酸后没有明显现象。同学们产生疑问:反应后溶液中的溶质是什么呢?对此同学们展开了以下实验探究。
[假设猜想]同学们给出了以下的猜想:
①只有NaSO4;②有 Na2SO4和H2SO4;③有______________;④有Na2SO4、H2SO4和NaOH。
你认为以上猜想中肯定不成立的是______________(填序号)。
[实验探究]为了探究其余的猜想,同学们做了如下的实验:
(1)李明同学取少量烧杯中的溶液于试管中,向其中滴加几滴无色酚酞溶液,没有明显变化,则原溶液中一定没有______________。
(2)张华也取少量样品溶液,向其中加入少量的碳酸钠溶液,发现立即有大量的气泡产生,产生气泡的化学反应方程式为______________,该现象可证明猜想②是正确的。
(3)李明又说,用Fe2O3固体同样也可以探究出猜想②是正确的,请你帮他写出具体的实验操作和现象:______________。
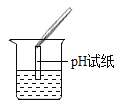
(4)受同学们的启发,小丽说用pH试纸也可以探究溶液成分,于是她用如图所示的方法测定该溶液的pH,结果小于7,也证明猜想②是正确的。但她的这种错误操作会产生的后果是______________。
(5)小刚说:“老师说过硫酸也可以和BaCl2溶液反应,生成硫酸钡白色沉淀,所以我们也可以用BaCl2溶液来探究。”于是他取少量样品溶液于试管中,向其中滴加几滴无色的BaCl2溶液,观察到产生白色沉淀,所以他证明猜想②是正确的。请问,小刚的结论是否正确,为什么?______________________________。
[得出结论]反应后的溶液中溶质是硫酸钠和硫酸。
[评价反思]在确定溶液中存在某物质时,要根据该物质性质来进行探究。我们已知物质的结构决定性质,之所以能选用以上步骤(2) 到步骤(4)方案进行验证,都与溶液中存在的微粒____________(填符号)有关。
【答案】Na2SO4和NaOH ④ NaOH ![]() 向盛有Fe2O3固体的试管中加入少量样品溶液,一段时间后观察到溶液变成浅黄色 污染原试剂 不正确,因为BaCl2和Na2SO4反应也能生成白色沉淀,不能证明含有H2SO4 H+
向盛有Fe2O3固体的试管中加入少量样品溶液,一段时间后观察到溶液变成浅黄色 污染原试剂 不正确,因为BaCl2和Na2SO4反应也能生成白色沉淀,不能证明含有H2SO4 H+
【解析】
氢氧化钠和硫酸反应会生成硫酸钠和水,碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,氧化铁和硫酸反应生成硫酸铁和水,硫酸钠和氯化钡反应生成硫酸钡沉淀。
[假设猜想]
①只有NaSO4;②有 Na2SO4和H2SO4;③有Na2SO4和NaOH;④有Na2SO4、H2SO4和NaOH。氢氧化钠和硫酸反应会生成氯化硫酸钠和水,不可以共存,所以上述猜想中肯定不成立的是④。
[实验探究]
(1) 酚酞遇碱变红色,李明同学取少量烧杯中的溶液于试管中,向其中滴加几滴无色酚酞溶液,没有明显变化,则原溶液中一定没有NaOH。
(2)碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,产生气泡的化学反应方程式为![]() ,该现象可证明猜想②是正确的。
,该现象可证明猜想②是正确的。
(3)硫酸和氧化铁反应生成硫酸铁和水,故实验操作和现象是向盛有Fe2O3固体的试管中加入少量样品溶液,一段时间后观察到溶液变成浅黄色。
(4)pH测定溶液pH值的正确操作是不能将pH试纸伸入待测溶液中,这样操作会产生的不良后果是污染原试剂。
(5)硫酸钠和氯化钡反应生成硫酸钡沉淀,小刚的结论不正确,因为BaCl2和Na2SO4反应也能生成白色沉淀,不能证明含有H2SO4。
[评价反思]
硫酸溶于水可以电离出氢离子和硫酸根离子,硫酸钠溶于水可以电离出钠离子和硫酸根离子,要验证硫酸要证明氢离子,离子符号为H+。

【题目】酸和碱发生的中和反应在日常生活和工农业生产中有着广泛的应用。下图表示盐酸和氢氧化钠溶液发生反应时烧杯中溶液的pH随加入液体体积的变化曲线及相关的实验操作。请从中获取信息回答下列问题:

(1)①烧杯中盛放的是_____溶液。
②曲线上坐标为(18,7)的点所表示的意义______。
③曲线上坐标为( 15, 12)的点表示的溶液中的微粒有_____________(用化学用语表示)。
(2)小明完成上述实验几天后发现,忘记盖上盛放氢氧化钠溶液试剂瓶的瓶塞。请帮助小明完成如下实验方案来检验氢氧化钠溶液是否变质。
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取少量溶液于试管中,滴加几滴稀盐酸。 | 没有气体产生。 | 没有变质 |
方案二 | 取少量溶液于试管中,滴加几滴氯化钡溶液。 | _________________ | 已经变质 |
②写出方案二中发生反应的化学方程式_______________________________。
③你认为方案一的实验设计是否正确?_______________(填“正确”或“不正确”)。请说明理由___________________。