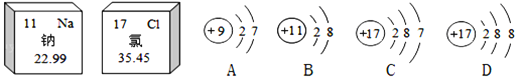题目内容
【题目】己知浓盐酸(HC1 气体的水溶液)与二氧化锰可以用于实验室制取氯气(Cl2), 化学方式为:MnO2+4HCl=Cl2↑+X+2H2O
(1)X 物质为_____________(填化学式);
(2)200g 质量分数为 36.5%的浓盐酸与足量二氧化锰反应制取氯气的质量为多少___________?
【答案】MnCl2. 34.5g
【解析】
(1)反应物中锰、氧、氢、氯原子的个数分别是1、2、4、4,生成物中锰、氧、氢、氯原子的个数分别是0、2、4、2,故X中含有1个锰原子和2个氯原子,故化学式为:MnCl2.
(2)设:200g 质量分数为 36.5%的浓盐酸与足量二氧化锰反应制取氯气的质量为x

得x=35.5g

【题目】在老师的指导下,某学习小组利用如图1所示装置对氯酸钾(KClO3)制氧气进行了深入的探究学习.
资料:
①KClO3的熔点约为356℃,MnO2的分解温度约为535℃.用酒精灯物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指KClO3和MnO2混合物中,KClO3和MnO2的质量比;
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图及不同配比时氧气浓度随温度的变化示意图如图:
(1)分析图2,KClO3分解温度___________(填“高于”、“等于”或“低于”)其熔点.
(2)分析图3,KClO3分解温度随物质配比变化的规律是__________当物质配比为1:2时,KClO3分解温度约为________℃.
(3)为证实MnO2的催化作用,小组同学利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性 | 气密性良好 |
Ⅱ | 分别在“Y”形管两侧支管中加入少量MnO2和KClO3,塞紧橡皮塞. | 没有明显现象 |
Ⅲ | 分别先后加热MnO2和KClO3,用带火星木条放在导管口.加热__________(填“左”或“右”)侧支管后,带火星木条复燃. | 木条长时间才能复燃 |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分MnO2混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口. | _____________ |
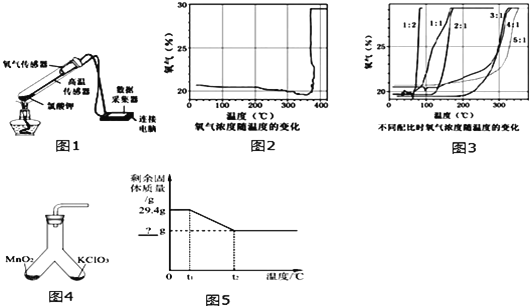
步骤Ⅳ的实验现象能否说明MnO2是KClO3分解的催化剂?___________(填“能”或“不能”),除催化剂外,影响化学反应的速率的因素还有___________和__________等.
(4)分析图2,在KClO3分解前,传感器得到氧气浓度降低的可能原因是____________.
(5)将29.4gKClO3和MnO2混合物以5:1配比加热至完全反应,如图5中?的值应为_________
A.4.9 B.9.6 C.14.9 D.19.8.