题目内容
为测定某石灰石样品中CaCO3的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应,也不溶于水)有关实验数据如下表:
(1)根据质量守恒定律计算,反应中生成二氧化碳的质量.
(2)求该石灰石中含CaCO3的质量分数.
| 反应前 | 反应后 | ||
| 实验 数据 |
烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯及剩余物的质量 |
| 150 克 | 12克 | 157.6克 | |
(2)求该石灰石中含CaCO3的质量分数.
分析:在本题中,分析表格数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.
解答:解:(1)根据质量守恒定律,二氧化碳的质量=150g+12g-157.6g=4.4g.
故答案为:4.4克;
(2)设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
=
x=10g
×100%≈83.3% 答:该石灰石中含CaCO3的质量分数是83.3%.
故答案为:83.3%.
故答案为:4.4克;
(2)设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
| 100 |
| x |
| 44 |
| 4.4g |
x=10g
| 10g |
| 12g |
故答案为:83.3%.
点评:本考点考查了根据化学方程式的计算,属于表格型计算题.要充分利用“遇到差值想气体”,根据质量守恒定律求气体的质量,然后再求其它物质的质量,要会分析表格的数据.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,本考点主要出现在计算题中.

练习册系列答案
相关题目
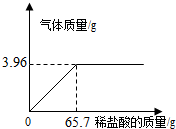 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: