题目内容
为测定某石灰石样品中碳酸钙的含量,取样品10g于烧杯中,再向其中加入稀盐酸60g,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为66.7g.
(1)生成CO2的质量m1为
(2)求石灰石样品中碳酸钙的质量分数.
(3)工业上煅烧石灰石也可得到CO2,取上述样品10g,用这种方法生成的CO2质量为m2,则m1
(1)生成CO2的质量m1为
3.3
3.3
g.(2)求石灰石样品中碳酸钙的质量分数.
(3)工业上煅烧石灰石也可得到CO2,取上述样品10g,用这种方法生成的CO2质量为m2,则m1
=
=
m2.分析:(1)碳酸钙与盐酸反应只放出一种气体二氧化碳使反应前后质量出现差异,因此,使用质量守恒定律,可由反应前后质量差计算出生成二氧化碳的质量;由反应放出二氧化碳的质量;
(2)据反应的化学方程式计算参加反应的碳酸钙的质量和盐酸中氯化氢的质量,碳酸钙质量与样品的质量比可计算石灰石样品中碳酸钙的质量分数.
(3)根据二氧化碳来源于碳酸钙的原理分析两种方法生成的二氧化碳的多少;
(2)据反应的化学方程式计算参加反应的碳酸钙的质量和盐酸中氯化氢的质量,碳酸钙质量与样品的质量比可计算石灰石样品中碳酸钙的质量分数.
(3)根据二氧化碳来源于碳酸钙的原理分析两种方法生成的二氧化碳的多少;
解答:解:(1)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量=60g+10.0g-66.7=3.3g;
(2)样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
=
x=7.5g
样品中碳酸钙的质量分数:
×100%=75.0%
(3)由于碳酸钙和盐酸反应与碳酸钙高温分解生成的二氧化碳都是来源于碳酸钙中的碳酸根,而样品质量相同,故生成的二氧化碳质量相同,即m1=m2;
故答案为:(1)3.3;(2)石灰石样品中碳酸钙的质量分数为75%;(3)=;
(2)样品中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
| 100 |
| x |
| 44 |
| 3.3g |
x=7.5g
样品中碳酸钙的质量分数:
| 7.5g |
| 10g |
(3)由于碳酸钙和盐酸反应与碳酸钙高温分解生成的二氧化碳都是来源于碳酸钙中的碳酸根,而样品质量相同,故生成的二氧化碳质量相同,即m1=m2;
故答案为:(1)3.3;(2)石灰石样品中碳酸钙的质量分数为75%;(3)=;
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
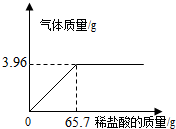 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: