题目内容
为测定某石灰石样品中碳酸钙的质量分数,取25克石灰石样品,放入盛有150克稀盐酸的烧杯中,恰好完全反应(杂质不反应),烧杯内物质质量变为166.2克.求:
①反应生成二氧化碳多少克?
②石灰石中碳酸钙的质量分数.
①反应生成二氧化碳多少克?
②石灰石中碳酸钙的质量分数.
分析:①石灰石的质量与稀盐酸的质量和去掉烧杯内剩余物质的质量所得的质量是生成二氧化碳的质量.
②由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
②由二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
解答:解:①生成二氧化碳的质量为
150g+25g-166.2g=8.8g
②设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 8.8g
=
x=20g
石灰石中碳酸钙的质量分数=
×100%=80%
答:①反应生成二氧化碳8.8g;
②石灰石中碳酸钙的质量分数为80%.
150g+25g-166.2g=8.8g
②设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 8.8g
| 100 |
| x |
| 44 |
| 8.8g |
x=20g
石灰石中碳酸钙的质量分数=
| 20g |
| 25g |
答:①反应生成二氧化碳8.8g;
②石灰石中碳酸钙的质量分数为80%.
点评:本题主要考查有关含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目
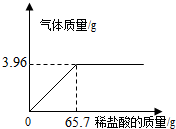 课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
课题小组为测定某石灰石样品中CaCO3的含量,取l0g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容: