题目内容
【题目】化学与实验.
(一)气体的制取和收集
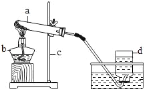
现有如图所示的实验装置:
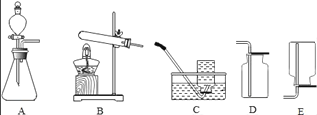
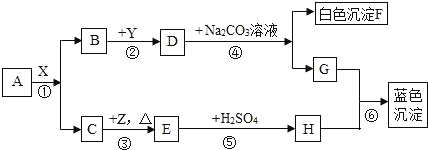
(1)A装置可用于制___气体,反应的化学方程式为:___.
(2)实验室需少量甲烷气,可用加热无水醋酸钠与碱石灰的固体混合物制得.制甲烷气的发生装置应选用___(填字母)装置;收集甲烷气可选用C或E装置,由此推断甲烷气具有的物理性质是___.
(3)实验室用A装置制取气体前,先向长颈漏斗中加水淹没长颈漏斗的下端,其目的是为了___.
(4)用B、D组合制取制氧气的化学方程式为___,检验氧气已集满的方法是___.
(二)某食品包装袋中有一个小纸袋,上面写“生石灰干燥剂,请勿食用”.该食品已放置两月有余.请你对下列问题进行探究.
(1)小纸袋中的物质能否继续作干燥剂?
实验步骤 | 实验现象 | 结论 |
取足量的小纸袋中的固体放入 烧杯中,加入适量的水,触摸杯壁 | ___ | 可继续作干燥剂 |
(2)猜想:小纸袋中的物质除含有CaO外,还可能含有Ca(OH)2和___;
(3)请设计实验证明(2)中你所填的物质是否存在___.
【答案】氢气、氧气、二氧化碳 Zn+H2SO4═ZnSO4+H2↑、2H2O2![]() 2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑ B 不溶于水,密度比空气小 防止二氧化碳从长颈漏斗逸出 2KMnO4
2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑ B 不溶于水,密度比空气小 防止二氧化碳从长颈漏斗逸出 2KMnO4![]() K2MnO4+MnO2+O2↑ 带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了 杯壁变热 CaCO3 加入足量的盐酸,观察是否产生气泡
K2MnO4+MnO2+O2↑ 带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了 杯壁变热 CaCO3 加入足量的盐酸,观察是否产生气泡
【解析】
(1)A装置可用于制氢气、氧气、二氧化碳,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑、2H2O2![]() 2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑.故填:氢气、氧气、二氧化碳;Zn+H2SO4═ZnSO4+H2↑、2H2O2
2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑.故填:氢气、氧气、二氧化碳;Zn+H2SO4═ZnSO4+H2↑、2H2O2![]() 2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑;
2H2O+O2↑、CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)实验室制甲烷气需要加热,应该用B装置作为发生装置;收集甲烷气可选用C或E装置,由此推断甲烷气具有的物理性质是不溶于水,密度比空气小.故填:B;不溶于水,密度比空气小;
(3)实验室用A装置制取气体前,先向长颈漏斗中加水淹没长颈漏斗的下端,其目的是为了:防止二氧化碳从长颈漏斗逸出.故填:防止二氧化碳从长颈漏斗逸出;
(4)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的验满方法是把带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了;故填:2KMnO4![]() K2MnO4+MnO2+O2↑;带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了;
K2MnO4+MnO2+O2↑;带火星的木条放在瓶口来验满,如果带火星的木条在瓶口能复燃,则证明该瓶氧气已经收集满了;
二、(1)可以继续做干燥剂,说明溶解于水有放热现象,故填:杯壁变热;
(2)氧化钙变质能生成氢氧化钙和碳酸钙,故还可能含有碳酸钙,故填:CaCO3;
(3)检验是否含有碳酸钙,可以加入足量的盐酸,观察有没有气泡产生,若有气泡产生,则含有碳酸钙,故填:加入足量的盐酸,观察是否产生气泡.

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】某同学将氢氧化钠溶液滴入到一定量的稀氯化铜溶液中,出现蓝绿色不溶于水的固体。该同学对生成蓝绿色而不是蓝色固体的现象产生疑惑。
(查阅资料)
(1)CuCl2溶液与NaOH溶液反应可生成蓝色固体(Cu(OH)2),在氢氧化钠较少的情况下会生成蓝绿色碱式氯化铜(Cux(OH)yClz),其不溶于水,能与酸反应。
(2)Cu(OH)2在60℃开始分解生成两种氧化物,100℃分解完全。碱式氯化铜在300℃开始分解生成氧化铜、水和氯化氢,在400℃分解完全。
(猜测)蓝绿色固体可能是:①Cu(OH)2;②Cux(OH)yClz晶体;③___。
猜想①的理由是:___(用化学方程式表示)。
(实验)该同学取31.25g蓝绿色固体,加热至100℃出现黑色固体。则猜想___不正确。继续加热到400℃至质量不再改变,并使产生的气体全部缓缓通过如图___(选填“甲”或“乙”)装置(装置中药品足量)。
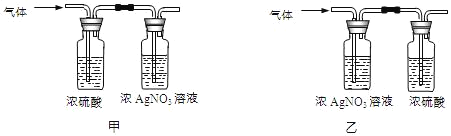
实验数据:①最终得到剩余固体24.00g;
②与硝酸银溶液反应得到的沉淀经过滤、洗涤和低温烘干,得到固体14.35g;
加热前 | 100℃ | 400℃ |
250.00g | 251.80g | 253.60g |
③浓硫酸装置中数据如表。
(延伸)
(1)碱式氯化铜常作为动物饲料的添加剂,则该碱式氯化铜与胃液发生反应的化学方程式为___。
(2)为使实验中生成蓝色固体,少出现蓝绿色固体,应作___改进(选填序号)。
a.实验中将氯化铜溶液滴加到氢氧化钠溶液中
b.实验中应提供足量、较浓的氢氧化钠溶液
c.实验应该在80℃的水浴中进行