题目内容
【题目】人类的生活和生产都离不开金属材料。
(一)铁材料的有关知识
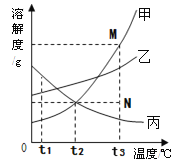
(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_________。
(2)下列说法不正确的是________________。(填字母序号)
A.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁;
B.回收废旧金属有利于节约金属资源;
C.在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液。
D.铁锅常用于炒饭炒菜,是利用了铁的导热性
铁制品锈蚀的过程,实际上是铁与空气中的_____________________等发生化学反应的过程。请写出一种防锈措施 __________________________________。
(二)请你参与探究几种常见金属饰品所含金属的相关活动,并回答下列问题。
现用一定量的AgNO3和Cu(NO3)2混合溶液,进行了如右图所示的实验,并对溶液A和固体B的成分进行了分析和研究。
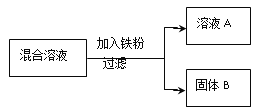
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Fe(NO3)2 ②有Fe(NO3)2 、AgNO3
③有Fe(NO3)2 、Cu(NO3)2 ④有___________________________。
【交流讨论】不合理的猜想是_______________(填标号)。
【实验探究】根据下表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想____________, 固体B中的金属成分为____________(写化学式)。 |
【数据处理】称取10克固体B于烧杯中,向烧杯中加入100克稀硫酸,恰好完全反应后称得烧杯内混合物的总质量为109.8克。请计算
(1)所用稀硫酸的溶质质量分数为多少?(请写出计算过程)
______
(2)若配制上述浓度的稀硫酸100克,则需质量分数98%的浓硫酸______克。
【答案】Al>Fe>CuA C水和氧气 涂油、镀层Fe(NO3)2 、Cu(NO3)2 、AgNO3②①Fe 、Cu、Ag9.8%10
【解析】
(1). 金属活动性是只金属的反应能力,活动性越强,越难以冶炼,在自然界中越易以化合物形式存在,反应,越弱,越易以单质存在或者越易被冶炼成金属单质。所以人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是Al>Fe>Cu (2). 铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁;金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au。在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。所以铁能与硫酸铜溶液反应,因而不能在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液。 (3铁制品锈蚀的过程,实际上是铁与空气中的氧气、水生化学反应的过程,所以防止生锈的方法有:保持金属表面洁净干燥、覆盖保护层、改变金属的组成和结构; (5). 向一定量的AgNO3和Cu(NO3)2混合溶液加入铁粉,硝酸银先与铁反应,剩余的铁再与硝酸铜反应。①如果铁的量足量,将硝酸银和硝酸铜反应完,则溶液中只有Fe(NO3)2 ③如果铁的量只能将硝酸银反应完,但不足以与硝酸铜反应或者反应掉部分硝酸铜,溶液中有Fe(NO3)2 、Cu(NO3)2 ;如果铁的量很少,只能反应掉部分硝酸银,则硝酸铜没有参与反应,溶液中有 Fe(NO3)2 、Cu(NO3)2 、AgNO3 (6).猜想 ②不合理 (7). 取少量反应后的固体B,滴加稀盐酸,有气泡产生,说明铁有剩余,则硝酸银、硝酸铜都反应完,溶液中 的溶质只有硝酸亚铁(8)固体B的成分有剩余的Fe 、生成的Cu、Ag (9). 称取10克固体B于烧杯中,向烧杯中加入100克稀硫酸,恰好完全反应后称得烧杯内混合物的总质量为109.8克。由质量守恒定律可知,反应前后物质的总质量不变,所以氢气的质量为:10克+100克-109.8克=0.2克,所用稀硫酸的溶质质量为x,则
Fe + H2SO4 = FeSO4 + H2↑,
98 2
x 0.2g
98/x=2/0.2g x=9.8g
所用稀硫酸的溶质质量分数为9.8g÷100g×100%=9.8%
配制上述浓度的稀硫酸100克,则需质量分数98%的浓硫酸的质量为y
100g×9.8%=y×98% y=10g
答:略