题目内容
73g质量分数为20%的盐酸与足量大理石充分反应.
(1)生成二氧化碳的质量是多少?
(2)反应完全后所得溶液的质量分数是多少?
(1)生成二氧化碳的质量是多少?
(2)反应完全后所得溶液的质量分数是多少?
分析:大理石的主要成分为碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,由参加反应的盐酸的质量可计算生成二氧化碳的质量,同时求出生成的氯化钙、参加反应的碳酸钙的质量.再根据质量守恒定律和溶质的质量分数的计算公式求出所得溶液质量分数.
解答:解:(1)设生成二氧化碳的质量为x,生成氯化钙的质量为y,参加反应的碳酸钙的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
z 73g×20% y x
=
=
=
解得:x=8.8g,y=22.2g z=20g
(2)反应完全后所得溶液的质量分数是:
×100%=26.4%.
答:(1)生成二氧化碳的质量是8.8g.(2)反应完全后所得溶液的质量分数是26.4%.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
z 73g×20% y x
| 100 |
| z |
| 73 |
| 73g×20% |
| 111 |
| y |
| 44 |
| x |
解得:x=8.8g,y=22.2g z=20g
(2)反应完全后所得溶液的质量分数是:
| 22.2g |
| 20g+73g-8.8g |
答:(1)生成二氧化碳的质量是8.8g.(2)反应完全后所得溶液的质量分数是26.4%.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
氯化钠是调味用的食盐的主要成分,也是重要的化工原料.电解食盐水可得氢氧化钠、氢气和氯气,写出电解食盐水的化学方程式 .
(1)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐.风吹日晒的作用是 ;将含有较多杂质的粗盐溶解后,可通过 操作除去其中的泥沙等不溶性杂质.
(2)某化学兴趣小组的同学在实验室用氢氧化钠溶液与稀盐酸做探究实验.为探究反应后溶液中溶质的可能组成,同学们作出了如下猜想:
①你认为甲、乙同学的猜想都合理吗?如有不合理的请说明理由.
②请你提出一个与甲、乙同学不同的猜想.你的猜想是 .请设计简单的实验证明你的猜想成立.
(3)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)海水中含有丰富的氯化钠,利用风吹日晒可以从海水中提取粗盐.风吹日晒的作用是
(2)某化学兴趣小组的同学在实验室用氢氧化钠溶液与稀盐酸做探究实验.为探究反应后溶液中溶质的可能组成,同学们作出了如下猜想:
| 甲同学的猜想 | 可能只有氯化钠 |
| 乙同学的猜想 | 可能含有氯化钠、氢氧化钠和稀盐酸 |
②请你提出一个与甲、乙同学不同的猜想.你的猜想是
(3)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
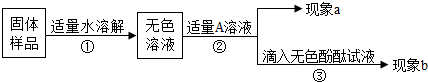
 (2013?许昌一模)在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.
(2013?许昌一模)在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.