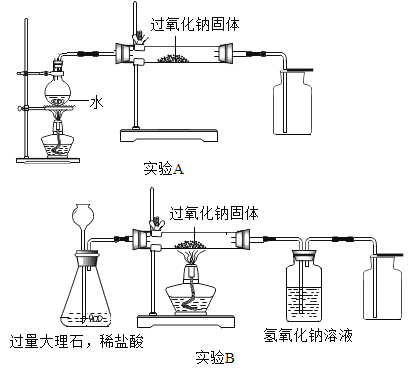
题目内容
【题目】NiSO46H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)为原料获得。有关工艺流程如图:
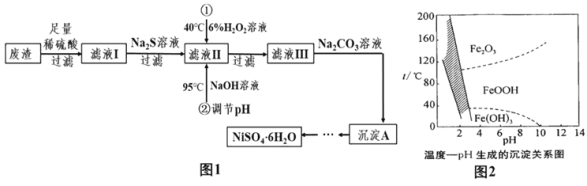
(相关资料)①Ni能与稀硫酸反应生成NiSO4和H2
②ZnSO4+Na2S=ZnS↓+Na2SO4
③H2O2溶液能将FeSO4氧化成Fe2(SO4)3
④NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀。
(问题解答)
(1)向废渣中加入足量稀硫酸的目的是_____。
(2)在滤液Ⅱ中加入H2O2溶液时,温度不能太高的原因是_____。
(3)除铁时还能加入适量的Na2CO3溶液调节酸度,反应生成Na2SO4、CO2气体和一种浅黄色的黄铁矾钠沉淀[化学式为:Na2Fe6(SO4)4(OH)12],这样可以将Fe3+除去。写出该反应的化学方程式_____。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域。下列说法正确的是_____(填序号)。
A FeOOH中铁元素为+2价
B Fe2O3固体为红色
C 若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中出现的沉淀是FeOOH和Fe(OH)3
D 工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右
(4)从“沉淀A”制得NiSO46H2O晶体的实验步骤依次为:向沉淀中加入_____溶液,直至恰好完全溶解,转化为NiSO4溶液;蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体,用少量乙醇洗涤NiSO46H2O晶体并晾干。
【答案】使废渣完全反应 温度过高H2O2会分解,降低原料利用率 6H2O+6Na2CO3+3Fe2(SO4)3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑ BD 稀硫酸
【解析】
(1)根据流程图可知,流程中存在向废渣中加入足量稀硫酸的目的是使废渣完全反应;
(2)温度过高H2O2会分解,降低原料利用率。在滤液Ⅱ中加入H2O2溶液时,温度不能太高;
(3)根据“除铁时还能加入适量的Na2CO3溶液调节酸度,反应生成Na2SO4、CO2气体和一种浅黄色的黄铁矾钠沉淀[化学式为:Na2Fe6(SO4)4(OH)12],这样可以将Fe3+除去”可知,该反应的反应物是H2O、Na2CO3、Fe2(SO4)3,生成物是Na2Fe6(SO4)4(OH)12、Na2SO4、CO2,化学方程式为:6H2O+6Na2CO3+3Fe2(SO4)3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
A FeOOH中,氧元素的化合价为-2价,氢元素为+1价,设:FeOOH中铁元素化合为x;根据化合物中各元素的化合价的代数和为零,则有:x+(-2)+(-2)+(+1)=0,x=+3,故A错误;
B Fe2O3固体为红色,故B正确;
C 根据温度—pH与生成的沉淀关系图可知,当温度低于40℃,pH=4时,沉淀主要是Fe(OH)3,当温度高于40℃,低于100℃左右,pH<4时,沉淀主要是FeOOH。若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中出现的沉淀是Fe(OH)3,故C错误;
D 根据温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾钠稳定存在的区域可知,工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH为1.5左右,故D正确,故选BD。
(4)根据“NiCO3是一种不溶于水、易溶于强酸的浅绿色沉淀”可知,从“沉淀A”制得NiSO46H2O晶体的实验步骤依次为:向沉淀中加入稀硫酸溶液,直至恰好完全溶解,转化为NiSO4溶液;蒸发浓缩、冷却结晶,过滤得NiSO46H2O晶体,用少量乙醇洗涤NiSO46H2O晶体并晾干。

【题目】分类、类比是学习化学常用的方法。
(1)初中化学实验方法有多种,如对比法、控制变量法、定量实验法、定性实验法等,若按实验方法分类,应将实验 ________________________(填字母)分为一类,依据是______________________________。
用pH 试纸测定溶液的pH |
探究铁生锈条件 |
探究氢氧化钠溶液与盐酸反应 |
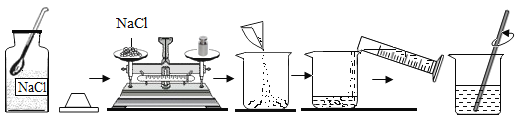
配置质量分数5%的NaCl 溶液 |
A | B | C | D |
(2)善于比较、归纳是良好的学习习惯。酸酐能与水化合生成相应的酸。依据酸酐中元素的化合价与酸中元素的化合价存在的规律,写出硝酸酸酐的化学式__________________;请写出三氧化二氮与水反应生成相应酸的化学方程式_______________________。
酸酐 | 酸 | 酸酐 | 酸 |
CO2 | H2CO3 | SO3 | H2SO4 |
Cl2O7 | HClO4 | ? | HNO3 |