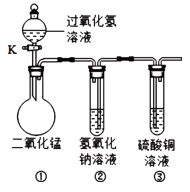
题目内容
【题目】某化学小组将一定量的稀盐酸滴入12.5 g的大理石(杂质不与稀盐酸反应)中制取CO2。产生CO2的质量与滴入稀盐酸的质量关系如下图所示,请回答:

(1)生成CO2的质量为_________ g;
(2)所用大理石中含碳酸钙的质量分数为_______________。
【答案】 4.4 g 80.0%
【解析】本题图像与化学方程式计算结合的综合题,根据图像读出生成二氧化碳的质量,再根据化学方程式和二氧化碳的质量可以求得参加反应的碳酸钙的质量,进而计算出样品中碳酸钙的质量分数。
(1)由图中数据可知,该实验最多制得CO2的质量为4.4g。
(2)设:生成4.4g二氧化碳需要碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
![]() =
=![]()
x=10g,
所用大理石中含碳酸钙的质量分数=![]() ×100%=80%
×100%=80%
答:所用大理石中含碳酸钙的质量分数为80%

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目