题目内容
【题目】A、B、C、D、E是九年级化学中常见的五种物质。已知C是人体胃液中可以帮助消化的物质,D是大理石的主要成分,其相互反应及转化关系如图所示,“一”表示相连的两物质之间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应条件、反应物、生成物已略去。
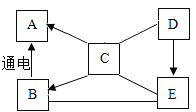
(1)写出下列反应的化学方程式。C与D的反应:______;C转化为A的反应:______
(2)B与E的反应是____反应(填“吸热”或“放热”)
(3)写出E物质的一种用途_____。
【答案】![]()
![]() (合理即可) 放热 干燥剂
(合理即可) 放热 干燥剂
【解析】
题目给出C是人体胃液中可以帮助消化的物质,D是大理石的主要成分,所以可以推出C为盐酸(HCl),D为碳酸钙(CaCO3),而B通过电解生成A,可以推出B为水(H2O),而水电解生成氢气和氧气,所以A为两者中一种,结合C盐酸可以制得A,所以可以推出A为氢气(H2),而D碳酸钙可以生成E,碳酸钙可以加热生成氧化钙和二氧化碳,而氧化钙可以与B水反应生成氢氧化钙,所以推出E为氧化钙(CaO),所以A为氢气,B为水,C为盐酸,D为碳酸钙,E为氧化钙。
(1)由分析可知,C与D是盐酸与碳酸钙反应生成氯化钙、二氧化碳和水,反应方程式为![]() ,C转化为A是盐酸制备氢气的反应,盐酸可与金属活动性中排在氢之前的金属反应制得氢气,此处选择来源较广的铁与盐酸反应制得氢气,所以方程式为
,C转化为A是盐酸制备氢气的反应,盐酸可与金属活动性中排在氢之前的金属反应制得氢气,此处选择来源较广的铁与盐酸反应制得氢气,所以方程式为![]() ;
;
(2)氧化钙与水反应生成氢氧化钙时温度升高,是一个放热反应;
(3)氧化钙吸水性较强,所以可以用作干燥剂。

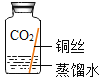
【题目】某些铜制品在空气中久置。表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
[查阅资料]①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
[进行实验]小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。

[解释与结论](1)依据以上现象分析,铜锈中一定含有的元素: Cu、O、_____
II.探究铜生锈的条件
[提出猜想]根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
[进行实验]实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
[解释与结论]
(2)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验②和③,得出的结论是_____。
(4)为验证猜想,请在图中将实验⑤补充完整。补充的物质应为_____。
(5)由上述实验可推知,铜生锈的条件是_____。