题目内容
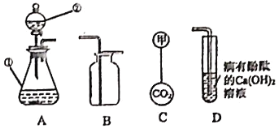
【题目】如图所示,进行中和反应实验:
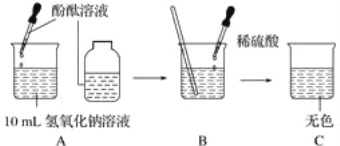
(1)在A的实验中,滴入酚酞溶液后,溶液由无色变为_____色。
(2)B中发生中和反应的化学方程式是_____。
(3)写出C的溶液中溶质可能存在的几组情况_____(用化学式表示)。
(4)使10 mL氢氧化钠恰好中和,需滴加溶有0.01 mol硫酸的稀硫酸溶液,求该10 mL氢氧化钠溶液中含氢氧化钠多少克?_____ (列式计算)
【答案】红 2NaOH+H2SO4===Na2SO4+2H2O Na2SO4或Na2SO4与H2SO4 0.8g
【解析】
(1)氢氧化钠溶液呈碱性,能使酚酞变红。在A的实验中,滴入酚酞溶液后,溶液由无色变为红色;
(2)氢氧化钠能与硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;
(3)酚酞在酸性和中性溶液中为无色,硫酸与氢氧化钠反应后的溶液C为无色,若恰好反应则溶液中只含有硫酸钠,若硫酸过量则还含有硫酸钠;C的溶液中溶质可能存在的几组情况是Na2SO4或Na2SO4与H2SO4;
(4)设:设10ml氢氧化钠溶液中含氢氧化钠的物质的量为x。。
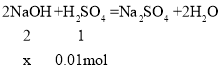
![]() x=0.02mol;
x=0.02mol;
氢氧化钠溶液中含氢氧化钠的质量=0.02 mol×40 g·mol-1=0.8 g。
答:该10 mL氢氧化钠溶液中含氢氧化钠0.8 g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目