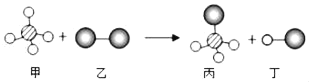
题目内容
【题目】某同学设计了如图所示的装置,用于实验室制取CO2,并对它的部分性质进行探究,按要求回答问题。
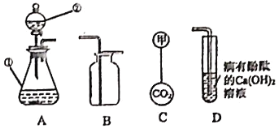
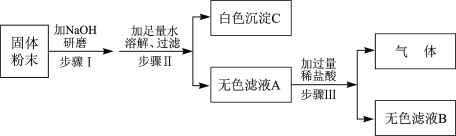
(1)写出上图所示装置中标有序号的仪器名称:① _________;② ___________;
(2)A装置用于制取CO2,反应的化学方程式为_______________________________;
(3)用B数置收集CO2的原因是__________________________________;
(4)若要C中的两个气球悬在空气中,则气体甲可能是__________.(填序号)
A 氢气 B 氧气 C 空气
(5)往D试管中通入CO2,当出现_____________现象,表示石灰水中的溶质恰好完全沉淀。
【答案】锥形瓶 分液漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ CO2密度比空气大 A 红色恰好褪去,白色沉淀不再生成
【解析】
(1)图中所示装置中标有序号的仪器名称:①是锥形瓶,②是长颈漏斗;
(2)实验室利用石灰石或大理石与稀盐酸制取二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)二氧化碳的密度大于空气密度,易溶于水,只能用向上排空气法收集;
(4)若要C中的两个气球悬浮在空气中,因为二氧化碳的密度大于空气密度,因此甲中的气体的密度必须小于空气密度,因此只能是氢气;
(5)滴有酚酞的氢氧化钙溶液是红色的,通入二氧化碳会和氢氧化钙反应生成碳酸钙和水,当反应完全时,红色恰好褪去,白色沉淀不再生成。
故答案为:(1)锥形瓶;分液漏斗(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)二氧化碳密度大于空气密度;(4)A;(5)红色恰好褪去,白色沉淀不再生成;

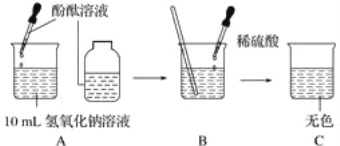
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
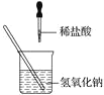
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |