题目内容
为了测定某铜锌合金中铜的质量分数,某实验小组的同学做了以下两组实验探究:(1)第一组同学设计了如下实验:
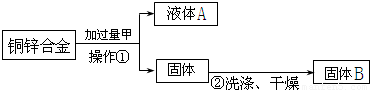
他们认为做完以上操作后,再称量所得固体B的质量,即可求出合金中铜的质量分数,从上述流程图中可以看出,操作①为______,甲物质可以是______,固体B为______,小刚发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是______.
(2)第二组同学利用该合金与稀硫酸反应,根据生成氢气的质量先求出锌的质量,从而解决了问题.他们共进行了三次实验,所得的相关实验数据记录如下(不计实验中产生的误差):
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 20 | 20 | 40 |
| 所用的稀硫酸的质量/g | 100 | 120 | 80 |
| 生成的氢气的质量/g | 0.4 | 0.4 | 0.4 |
(1)当所取合金与所用稀硫酸的质量比为______时,合金中的锌与稀硫酸恰好完全反应.
(2)求该合金中铜的质量分数.(写出计算过程)
【答案】分析:(1)根据过滤的原理分析操作①,根据合金中铜、锌的性质分析加入的甲物质,要计算合金中铜的质量分数,已经知道了铜的质量,还必须知道合金的质量;
(2)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了;第三次所取的合金是前两次的2倍,如果合金中的锌完全反应,应该产生0.8g气体,而实际上产生的气体和前两次相同只有0.4g,说明第三次反应中稀硫酸不足量,锌过量;由生成的气体量可知第三次参加反应的锌和前两次相同.
解答:解:(1)由流程图中可以看出操作①是将固液分开,所以操作①为过滤.由于锌能与酸反应,铜不能与酸反应,为了能得到铜,应加入硫酸或盐酸;要计算合金中铜的质量分数,已经知道了铜的质量.还必须知道合金的质量.所以,试验中缺少一步骤是:称量合金的质量;
(2)由第三次可知生成0.4克氢气使只消耗80克稀硫酸,所以20g合金中的锌和80g稀硫酸可恰好完全反应,即合金和稀硫酸的质量比为20g:80g=1:4时,二者能恰好完全反应.
(2)设20g铜、锌合金中含有锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
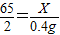 解得:X=13g
解得:X=13g
所以20g铜、锌合金中含有铜的质量为20g-13g=7g
铜、锌合金中铜的质量分数为 ×100%=35%
×100%=35%
答:(1)过滤,稀硫酸或稀盐酸,铜,称量合金的质量;(2)1:4,该铜、锌合金中铜的质量分数是35%.
点评:此题考查的是根据化学方程式的有关计算,正确分析处理表中的数据是解答此题的关键,真正理解了题意解此题就会很简单.此题属于比较难的题目.
(2)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了;第三次所取的合金是前两次的2倍,如果合金中的锌完全反应,应该产生0.8g气体,而实际上产生的气体和前两次相同只有0.4g,说明第三次反应中稀硫酸不足量,锌过量;由生成的气体量可知第三次参加反应的锌和前两次相同.
解答:解:(1)由流程图中可以看出操作①是将固液分开,所以操作①为过滤.由于锌能与酸反应,铜不能与酸反应,为了能得到铜,应加入硫酸或盐酸;要计算合金中铜的质量分数,已经知道了铜的质量.还必须知道合金的质量.所以,试验中缺少一步骤是:称量合金的质量;
(2)由第三次可知生成0.4克氢气使只消耗80克稀硫酸,所以20g合金中的锌和80g稀硫酸可恰好完全反应,即合金和稀硫酸的质量比为20g:80g=1:4时,二者能恰好完全反应.
(2)设20g铜、锌合金中含有锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
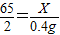 解得:X=13g
解得:X=13g所以20g铜、锌合金中含有铜的质量为20g-13g=7g
铜、锌合金中铜的质量分数为
 ×100%=35%
×100%=35% 答:(1)过滤,稀硫酸或稀盐酸,铜,称量合金的质量;(2)1:4,该铜、锌合金中铜的质量分数是35%.
点评:此题考查的是根据化学方程式的有关计算,正确分析处理表中的数据是解答此题的关键,真正理解了题意解此题就会很简单.此题属于比较难的题目.

练习册系列答案
相关题目
为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表.
(1)计算该铜锌合金中锌的质量分数.
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
| 实验 物质用量 |
第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
为了测定某铜锌合金中铜的质量分数,取合金样品跟稀盐酸反应.三次实验的有关数据如下表:
(1)根据上表中的数据分析,当铜锌合金中的锌与稀盐酸中的HCl恰好完全反应时,合金样品的质量与稀盐酸的质量之比为 .
(2)计算该铜锌合金中铜的质量分数. .
| 实验编号 | 所需合格样品的质量/g | 所取稀盐酸的质量/g | 生成氢气的质量/g |
| 1 | 10.0 | 40.0 | 0.1 |
| 2 | 10.0 | 50.0 | 0.1 |
| 3 | 20.0 | 36.5 | 0.1 |
(2)计算该铜锌合金中铜的质量分数.
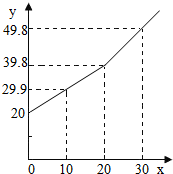 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: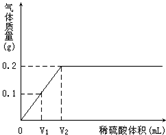 为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题: