题目内容
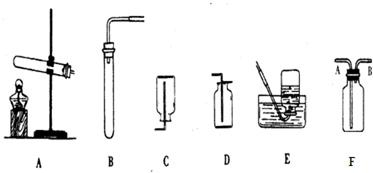
化学实验室里,老师给同学们准备了如下实验装置

(1)小明同学用双氧水和二氧化锰反应来制取氧气,他应写出的化学方程式为
(2)甲烷是一种无色、无味,难溶于水,密度比空气小的气体.小玲用加热醋酸钠和碱石灰(均为固体)的方法制取甲烷,小玲应选择制取甲烷的发生和收集装置是
(3)小丁同学向盛5%双氧水溶液的试管中加入少量二氧化锰,然后将带火星的木条伸入试管,未见木条复燃.你认为带火星的木条未复燃的原因是

(1)小明同学用双氧水和二氧化锰反应来制取氧气,他应写出的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,在这个反应中二氧化锰的作用是
| ||
催化作用
催化作用
,选择的发生装置是B
B
(填序号),能用D收集的原因是氧气的密度比空气大
氧气的密度比空气大
.(2)甲烷是一种无色、无味,难溶于水,密度比空气小的气体.小玲用加热醋酸钠和碱石灰(均为固体)的方法制取甲烷,小玲应选择制取甲烷的发生和收集装置是
A
A
、C或E
C或E
(填序号).若用如图F装置收集甲烷,甲烷应从B
B
端进入(选填“A”或“B”).(3)小丁同学向盛5%双氧水溶液的试管中加入少量二氧化锰,然后将带火星的木条伸入试管,未见木条复燃.你认为带火星的木条未复燃的原因是
5%双氧水溶液的浓度太低
5%双氧水溶液的浓度太低
.要使带火星的木条复燃,可对该实验作怎样的改进?可使用浓度大的过氧化氢溶液且加入二氧化锰
可使用浓度大的过氧化氢溶液且加入二氧化锰
.分析:(1)双氧水制取氧气时二氧化锰是催化剂,利用双氧水的状态以及反应的条件选择制取装置,利用氧气的密度选择收集装置.
(2)甲烷的制取需要的反应物状态及条件可选择制取装置,依据其密度选择收集装置.
(3)未见木条复燃,可能是因为5%双氧水溶液的浓度太低;改进方法有:可使用浓度大的过氧化氢溶液且加入二氧化锰.
(2)甲烷的制取需要的反应物状态及条件可选择制取装置,依据其密度选择收集装置.
(3)未见木条复燃,可能是因为5%双氧水溶液的浓度太低;改进方法有:可使用浓度大的过氧化氢溶液且加入二氧化锰.
解答:解:(1)双氧水制取氧气时生成水与氧气,该过程中二氧化锰是催化剂,所起的作用是催化作用,因为双氧水的状态是液态,以及反应的条件不需要加热,可选择制取装置是B,利用氧气的密度比空气大选择收集装置D.
故答案为:2H2O2
2H2O+O2↑;催化作用;B;氧气的密度比空气大;
(2)甲烷的制取需要的反应物状态是固体及条件是加热可选择制取装置是A,依据其密度比空气小且不易溶于水选择收集装置是C或E;甲烷的密度比空气小,甲烷应从B端进入;
故答案为:A;C或E;B;
(3)未见木条复燃,可能是因为5%双氧水溶液的浓度太低;改进方法有:可使用浓度大的过氧化氢溶液且加入二氧化锰.
故答案为:5%双氧水溶液的浓度太低;可使用浓度大的过氧化氢溶液且加入二氧化锰.
故答案为:2H2O2
| ||
(2)甲烷的制取需要的反应物状态是固体及条件是加热可选择制取装置是A,依据其密度比空气小且不易溶于水选择收集装置是C或E;甲烷的密度比空气小,甲烷应从B端进入;
故答案为:A;C或E;B;
(3)未见木条复燃,可能是因为5%双氧水溶液的浓度太低;改进方法有:可使用浓度大的过氧化氢溶液且加入二氧化锰.
故答案为:5%双氧水溶液的浓度太低;可使用浓度大的过氧化氢溶液且加入二氧化锰.
点评:本题主要考查化学方程式的书写和实验装置的选取,要同学们了解常见气体的性质与制取装置之间的关系.

练习册系列答案
相关题目
 27、化学实验室里,老师给同学们准备了如下实验装置:
27、化学实验室里,老师给同学们准备了如下实验装置:
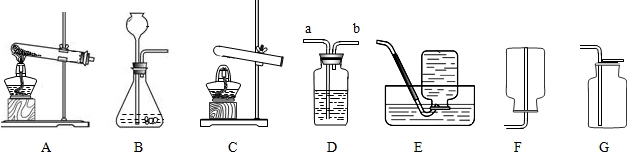 (1)小明同学用过氧化氢溶液和二氧化锰来制取氧气,该反应的化学符号表达式为:
(1)小明同学用过氧化氢溶液和二氧化锰来制取氧气,该反应的化学符号表达式为: (1)小明同学用过氧化氢溶液和二氧化锰来制取较纯净氧气,发生的化学反应的符号表达式为
(1)小明同学用过氧化氢溶液和二氧化锰来制取较纯净氧气,发生的化学反应的符号表达式为