题目内容
【题目】请根据下列实验装置图回答问题:
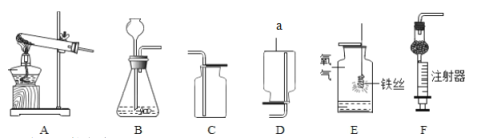
(1)仪器a的名称是_____
(2)实验室用过氧化氢和二氧化锰制取氧气,选用的发生装置是_____(填字母序号),其中二氧化锰的作用为_____。装置E中,铁丝与氧气反应的化学方程式为_____。
(3)实验室制取二氧化碳的化学方程式为_____;选用的收集装置是_____(填字母序号)。制取二氧化碳时,用装置F替代装置B的优点是_____。
(4)氨气是一种无色、有强烈刺激性臭味的气体,极易溶于水,水溶液呈碱性。实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气。某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究。
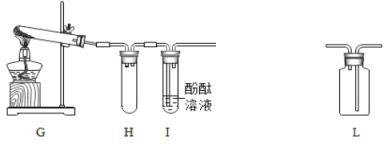
①写出G装置制取氨气的化学方程式_____;
②装置H的作用是_____;
③用L装置收集氨气,应从_____(长或短)导管进。
【答案】集气瓶 B 催化作用 3Fe+2O2![]() Fe3O4 CaCO3+2HCl=CaCl2+H2O+CO2↑ C 可以控制反应的发生和停止 2NH4Cl+Ca(OH)2
Fe3O4 CaCO3+2HCl=CaCl2+H2O+CO2↑ C 可以控制反应的发生和停止 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 防止液体倒吸 短
CaCl2+2H2O+2NH3↑ 防止液体倒吸 短
【解析】
(1)据图可知仪器a是集气瓶;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,用的发生装置是B,其中二氧化锰起催化作用;铁丝与氧气在点燃的条件下生成四氧化三铁,反应的化学方程式为3Fe+2O2![]() Fe3O4;
Fe3O4;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,选用的收集装置是C;制取二氧化碳时,用装置F替代装置B的优点是:可以控制反应的发生和停止;
(4)实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气,同时生成氯化钙和水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,因此需要加热;装置H的作用是:防止液体倒吸;用L装置收集氨气,应从短导管进,因为氨气的密度比空气小。
CaCl2+2H2O+2NH3↑,因此需要加热;装置H的作用是:防止液体倒吸;用L装置收集氨气,应从短导管进,因为氨气的密度比空气小。

【题目】为了测定某地石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行如下实验:(请写出详细的计算过程)
实验 | 1 | 2 | 3 | 4 |
加入样品的质量(g) | 5 | 10 | 15 | 20 |
生成CO2的质量(g) | 1.76 | 3.52 | 4.4 | 4.4 |
(1)计算这种石灰石样品中碳酸钙的质量分数___.
(2)计算出实验所用稀盐酸中HCl的质量分数___.