题目内容
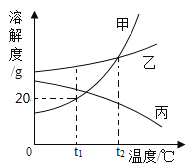
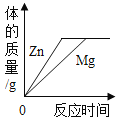
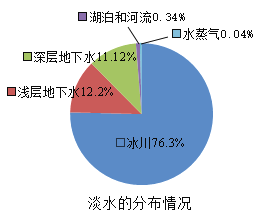
【题目】地球上水的分布是:海洋咸水97%,淡水3%,而淡水的分布又如图所示。
(1)淡水资源很有限,为了从海水中获得淡水,可采用的方法是_____(选填“过滤”或“蒸发”)。
(2)为了判断井水是硬水还是软水,可用_____进行检验。
(3)自来水生产中加氯气的反应原理是:氯气(Cl2)与水反应生成盐酸和次氯酸(HClO),请写出该反应的化学反应方程式_____;与净水器接通电源时产生紫外线类似,其作用是_____。
(4)春播时旱情严重,为缓解旱情,可使用液氮(N2)作为增雨剂实施人工降雨。根据你现有的知识推测下列说法中正确的是_____(填标号)。
A 液氮是一种溶液
B 液氮是由分子构成的
C 液氮气化时吸收热量
D 使用液氮会污染环境,应严格控制使用
(5)请你写出一条保护水资源的措施:_____。
【答案】蒸发 肥皂水 ![]() 杀菌消毒 B、C 生活污水经处理达到标准后再排放(合理答案即可)
杀菌消毒 B、C 生活污水经处理达到标准后再排放(合理答案即可)
【解析】
(1)过滤只能除去水中的不溶物,蒸发可将海水中的水变为水蒸气,然后冷凝得到淡水,故填:蒸发;
(2)通常用肥皂水检验硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,故填:肥皂水;
(3)氯气(Cl2)与水反应生成盐酸和次氯酸(HClO),该反应的化学方程式为:![]() ;
;
紫外线具有杀菌消毒的作用,故其作用是杀菌消毒;
(4)A、液氮是液态氮气,属于纯净物,不是溶液,不符合题意;
B、液氮是液态氮气,氮气由氮分子构成,符合题意;
C、液氮汽化时能吸收大量的热量,符合题意;
D、氮气是空气的组成成分之一,不会污染环境,不符合题意。
故选BC。
(5)保护水资源,一是节约用水,二是防止水污染,故保护水资源的措施有:生活污水经处理达到标准后再排放,用淘米水浇花等。

【题目】碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
[查阅资料]补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应,高温灼烧时会燃烧或分解。
[设计实验]根据资料和已学知识,该小组同学设计如下两种实验方案进行测定。
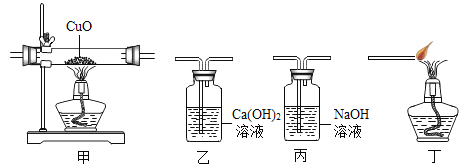
方案①:根据下图所示装置实验。
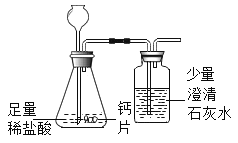
(1)锥形瓶中发生反应的化学方程式为___________________。
(2)长颈漏斗下端插入液面下的目的是___________________。
(3)记录数据如下:
钙片质量 | 空洗气瓶质量 | 澄清石灰水质量 | 反应后洗气瓶及瓶内物质总质量 |
25g | 100g | 50g | 150.4g |
方案②:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100g, 加入钙片质量为25g):
加入稀盐酸的总质量 | 100g | 200g | 300g | 400g |
充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
[分析评价]
方案①和方案②中合理是方案___________________,原因是___________________。
[得出结论]经过计算,该钙片中碳酸钙的质量分数是___________________。
[反思回顾]该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是___________________。
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ、挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到_____,原因是_____。
Ⅱ、不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体
(1)硝酸分解的化学方程式为:_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 |
|
|
|
实验现象 | 6分钟出现浅红棕色 15分钟红棕色比较明显 30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色 6分钟红棕色比较明显 10分钟红棕色非常明显 |
(2)实验①、②对比是研究_____对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_____。
Ⅲ、酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_____。
IV、氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是_____。