题目内容
某石灰厂有一批石灰石原料,为了测定该石灰石中碳酸钙的质量分数,厂化验室技术员称取12.5g研碎的石灰石粉末,进行四次高温煅烧(杂质没有变化)、冷却、称量剩余固体质量的重复操作,记录数据如下:(提示:碳酸钙在高温下分解,生成氧化钙和二氧化碳)
| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量 | 11.1g | 8.7g | 8.1g | 8.1g |
(2)石灰石样品中含碳酸钙的质量分数
(3)充分煅烧20t这种石灰石,可制得含杂质的生石灰的质量.
解:(1)根据质量守恒定律,生成的二氧化碳的质量=12.5g-8.1g=4.4g,故答案为:4.4
(2)设碳酸钙的质量分数为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x?12.5g 4.4g
 x=80% 答:石灰石样品中含碳酸钙的质量分数是80%.
x=80% 答:石灰石样品中含碳酸钙的质量分数是80%.
故答案为:80%
(3)20t×80%=16t
设生石灰的质量为y
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
16t y
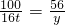 y=8.96t
y=8.96t
含杂质的生石灰的质量=8.96t+(20t-16t)=12.96t 答:含杂质的生石灰的质量是12.96t.
故答案为:12.96t
分析:根据质量守恒定律,生成的二氧化碳的质量=12.5g-8.1g=4.4g,根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,根据二氧化碳的质量可以求出碳酸钙的质量,再求出质量分数;最后根据20t这种石灰石中碳酸钙的质量,求出制得含杂质的生石灰的质量.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”“遇到杂质先求纯”.本考点主要出现在计算题中.
(2)设碳酸钙的质量分数为x
CaCO3
 CaO+CO2↑
CaO+CO2↑100 44
x?12.5g 4.4g
 x=80% 答:石灰石样品中含碳酸钙的质量分数是80%.
x=80% 答:石灰石样品中含碳酸钙的质量分数是80%.故答案为:80%
(3)20t×80%=16t
设生石灰的质量为y
CaCO3
 CaO+CO2↑
CaO+CO2↑100 56
16t y
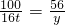 y=8.96t
y=8.96t含杂质的生石灰的质量=8.96t+(20t-16t)=12.96t 答:含杂质的生石灰的质量是12.96t.
故答案为:12.96t
分析:根据质量守恒定律,生成的二氧化碳的质量=12.5g-8.1g=4.4g,根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,根据二氧化碳的质量可以求出碳酸钙的质量,再求出质量分数;最后根据20t这种石灰石中碳酸钙的质量,求出制得含杂质的生石灰的质量.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律,还要记牢“遇到差值要想气体”“遇到杂质先求纯”.本考点主要出现在计算题中.

练习册系列答案
相关题目
 化学兴趣小组的同学在综合实践中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2g这种石灰石样品,并取稀盐酸20g分4次加入样品中进行实验,结果如下:
化学兴趣小组的同学在综合实践中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2g这种石灰石样品,并取稀盐酸20g分4次加入样品中进行实验,结果如下:| 稀盐酸的用量/g | 剩余固体的质量/g |
| 第一次加入5 | 1.5 |
| 第二次加入5 | 1.0 |
| 第三次加入5 | 0.5 |
| 第四次加入5 | 0.3 |
(2)2g此石灰石样品与足量稀盐酸反应最多生成CO2的质量?
 化学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20g分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表,利用实验数据绘制的图象见下图.(保留一位有效数字)
化学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20g分4次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表,利用实验数据绘制的图象见下图.(保留一位有效数字) 某石灰厂有一批石灰石原料,其中含有的杂质不与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用2g这种石灰石样品,并把20g稀盐酸分四次加入,充分反应后,经过滤、干燥等操作后,根据每次稀盐酸用量及剩余固体质量和实验数据绘制成图象(如图).计算:
某石灰厂有一批石灰石原料,其中含有的杂质不与盐酸反应.为了测定该石灰石的纯度,兴趣小组的同学取用2g这种石灰石样品,并把20g稀盐酸分四次加入,充分反应后,经过滤、干燥等操作后,根据每次稀盐酸用量及剩余固体质量和实验数据绘制成图象(如图).计算: