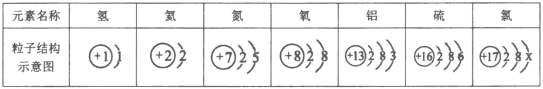
��Ŀ����
����Ŀ��һ�����庬��п�ۡ�̼�ۡ�����ͭ���������ơ��Ȼ����е�һ�ֻ��֡�Ϊ̽���������ɣ�ij��ѧ��ȤС�������������ʾʵ�飺
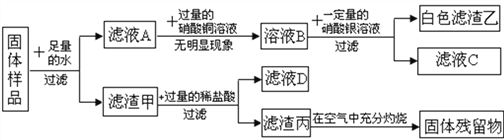
��ش��������⣺
�Ÿ�ʵ�������ɰ�ɫ�����ҵĻ�ѧ����ʽΪ_________��
��ԭ������һ�������е������� ________(д��ѧʽ����ͬ)��֤����_________��
��ԭ������һ�����е������� ____________��
��ʵ���������ȤС�齫��ҺC����ҺD�����뵽��Һ�ף��а�ɫ�������ɣ��ϲ���ҺEΪ��ɫ��������E�в��������ӣ���E��һ�����е�������______��
���𰸡� AgNO3+KCl=AgCl��+KNO3 NaOH ����Cu(NO3)2��Һ�������������������ɫ���� KCl��Zn��CuO KNO3��Zn(NO3)2��Cu(NO3)2��HNO3
����������1��п�ۡ�̼�ۡ�����ͭ������ˮ������ҺA�п��ܺ����������ơ��Ȼ��أ���������ͭ������������˵���������������ƣ��������������а�ɫ�������ɣ��ʰ�ɫ�������Ȼ�������Ӧ����ʽΪAgNO3+KCl=AgCl��+KNO3��
��2����ҺA�м�������ͭ������������˵���������������ƣ���������������������ƵĻ�����������ͭ������ɫ��������ͭ�������ɣ�
��3���������п��ܺ���п�ۡ�̼�ۡ�����ͭ������ϡ�����̼�۲��ܽ⣬Ҳ����Ӧ���������ڿ��������գ��й�����������������һ����̼��Ӧ��������ͭ����ϡ���ᷴӦ�����Ȼ�ͭ���Ȼ�ͭ��п��Ӧ�����Ȼ�п��ͭ��ͭ������������ͭ����ԭ�������һ�����Ȼ��أ�п������ͭ��
��4����ҺC�е�����������ͭ��������������أ���ҺD�е����������ᣬ�Ȼ�ͭ���Ȼ�п���ʰ�ɫ�������Ȼ���������E�в����������ӣ�˵�����ᡢ�Ȼ�п���Ȼ�ͭ����������Ӧ��ȫ���ֱ����������ᣬ����þ������ͭ������أ���E��һ��KNO3��Zn(NO3)2 ��Cu(NO3)2 ��HNO3��