��Ŀ����
����Ŀ��������ѧ��ѧ֪ʶ�ش����⣺
(1)����������������������=������ա�
����������������_____��ԭ�ӣ�
�ڷе㣺N2_____O2��
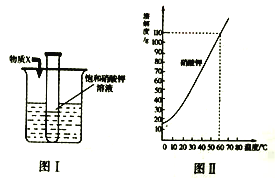
�۽�����ϡ���ᷴӦ�ľ��ҳ̶ȣ�þ_____����
��20����1.0g�����2.0g��������ȫȼ�պ����ɵĶ������������_____3.0g��
������KClO3��MnO2(����)�����ȡ��������MnO2�ڷ�Ӧǰ����������е�������������Ӧǰ_____��Ӧ��
(2)��ͼ��ʾ�����ڸܸ�ƽ����������ʵ�顣
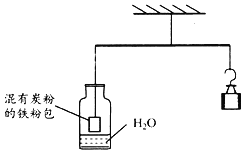
һ��ʱ�����̿�۵����۰�_____ (���������������½�����������)��ԭ����_____��
���𰸡� = �� �� �� �� �½� ����̿�۵����۰���ˮ��������Ӧ�ᷢ����ʴ����������
�������������ۺϿ����˻�ѧʽ�����ϼۺ������غ㶨�ɵ����֪ʶ��
��1����ԭ�ӵõ�1�������γ��������ӣ�������������������=��ԭ����
�ڵ����ķе���-196�棬�����ķе���-183�档�����ķе��������ķе㣻
��þ�Ľ�����Ա���ǿ������ͬ��������Խ���õĽ�����ϡ���ᷴӦԽ���ң����Խ�����ϡ���ᷴӦ�ľ��ҳ̶ȣ�þ������
����������ڵ�ȼ�����������ɶ����������������������1��1������20����1.0g�����2.0g��������ȫȼ�գ��������������ɵĶ��������������3.0g��
�ݶ�������������طֽ�Ĵ������ڷ�Ӧǰ���������䣬���ǹ����������٣�����MnO2�ڷ�Ӧǰ����������е�������������Ӧǰ����Ӧ��
��2������̿�۵����۰���ˮ��������Ӧ�ᷢ����ʴ��������������һ��ʱ������۰��½���

 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�����Ŀ����һ�������������ƺ��Ȼ�粒���������ȣ���÷�Ӧǰ������ʵ��������±���
���� | NaOH | NH4Cl | NaCl | H2O | X |
��Ӧǰ����/g | 8.0 | 10.7 | 0 | 0 | 0 |
��Ӧ������/g | 0 | 0 | 11.7 | 3.6 | a |
�ٱ���a��ֵΪ2.8��X��һ���ǻ������X��һ��������Ԫ�آ�X�����Ǹ÷�Ӧ�Ĵ�����X����Է�������Ϊ17��X��һ�����⡢��Ԫ�أ���������Ϊ2��7��X�е�Ԫ�ص���������ԼΪ82.4%��������˵���ж���ȷ���ǣ�������
A. �٢ڢ���ȷ B. ֻ�Тݢ���ȷ C. ֻ�Тޢ���ȷ D. ֻ�Т٢���ȷ