题目内容
某固体样品含一定质量的碳酸钙和22.2 g氯化钙,此固体样品与一定量的稀盐酸恰好完全反应,所得溶液的质量为 100.8 g,测得溶液中钙元素的质量为12 g。试计算:
(1)反应后所得溶液中溶质的质量是_____ g。
(2)固体样品中钙元素、碳元素、氧元素的质量比为_____(结果用最简整数比表示)。
(3)稀盐酸中溶质的质量分数。
(1)反应后所得溶液中溶质的质量是_____ g。
(2)固体样品中钙元素、碳元素、氧元素的质量比为_____(结果用最简整数比表示)。
(3)稀盐酸中溶质的质量分数。
(1)33.3 g
(2)10∶1∶4
(3)10%
(2)10∶1∶4
(3)10%
分析:(1)固体样品中的碳酸钙与稀盐酸恰好完全反应,使得反应后溶液为变成氯化钙溶液;根据溶液中钙元素的质量,利用氯化钙中钙元素质量分数,计算溶质氯化钙的质量;
(2)根据题意,样品中氯化钙溶于水而碳酸钙溶于盐酸,因此固体样品中钙元素质量即反应后溶液中钙元素质量;而样品中氯化钙不含碳元素、氧元素,因此需要计算出样品中碳酸钙的质量以计算样品中碳、氧元素的质量;可假设出碳酸钙的质量,然后由反应的化学方程式解决碳酸钙的质量;
(3)计算稀盐酸中溶质的质量分数,需要解决稀盐酸的质量及其中溶质HCl的质量,溶质HCl的质量可根据化学方程式,由碳酸钙的质量计算求得;而稀盐酸的质量需要利用质量守恒定律进行计算.
解答:解:(1)反应后所得溶液中溶质氯化钙的质量=12g÷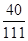 ×100%=33.3g
×100%=33.3g
(2)设样品中碳酸钙的质量为x,反应生成氯化钙的质量=33.3g-22.2g=11.1g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1g
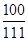 =
=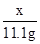
x=10g
固体样品中钙元素、碳元素、氧元素的质量比=12g:(10g×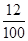 ×100%):(10g×
×100%):(10g×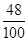 ×100%)=10:1:4
×100%)=10:1:4
故答案为:(1)33.3;
(2)10:1:4;
(3)设反应消耗HCl的质量为y,生成二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 111 44
y 11.1g z
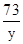 =
=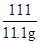 =
=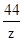
解之得y=7.3g,z=4.4g
稀盐酸中溶质的质量分数=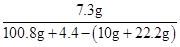 ×100%=10%
×100%=10%
答:稀盐酸中溶质的质量分数为10%.
(2)根据题意,样品中氯化钙溶于水而碳酸钙溶于盐酸,因此固体样品中钙元素质量即反应后溶液中钙元素质量;而样品中氯化钙不含碳元素、氧元素,因此需要计算出样品中碳酸钙的质量以计算样品中碳、氧元素的质量;可假设出碳酸钙的质量,然后由反应的化学方程式解决碳酸钙的质量;
(3)计算稀盐酸中溶质的质量分数,需要解决稀盐酸的质量及其中溶质HCl的质量,溶质HCl的质量可根据化学方程式,由碳酸钙的质量计算求得;而稀盐酸的质量需要利用质量守恒定律进行计算.
解答:解:(1)反应后所得溶液中溶质氯化钙的质量=12g÷
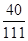 ×100%=33.3g
×100%=33.3g(2)设样品中碳酸钙的质量为x,反应生成氯化钙的质量=33.3g-22.2g=11.1g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111
x 11.1g
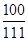 =
=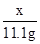
x=10g
固体样品中钙元素、碳元素、氧元素的质量比=12g:(10g×
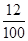 ×100%):(10g×
×100%):(10g×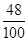 ×100%)=10:1:4
×100%)=10:1:4故答案为:(1)33.3;
(2)10:1:4;
(3)设反应消耗HCl的质量为y,生成二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 111 44
y 11.1g z
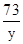 =
=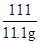 =
=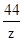
解之得y=7.3g,z=4.4g
稀盐酸中溶质的质量分数=
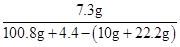 ×100%=10%
×100%=10%答:稀盐酸中溶质的质量分数为10%.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目