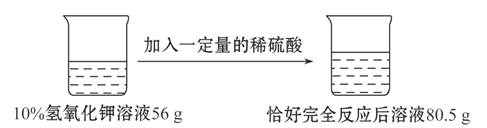
题目内容
在46.5g硫酸钠和氯化钠组成的混合物中,加入72.8g水,再加入104g溶质质量分数为20%的氯化钡溶液恰好完全反应,滤出沉淀(过滤时损耗不计),求:
(1)原混合物中硫酸钠的质量;
(2)反应后所得溶液中溶质的质量分数.
(1)原混合物中硫酸钠的质量14.2g;(2)反应后所得溶液中溶质的质量分数22%.
解析试题分析:设原混合物中Na2SO4的质量为x,生成NaCl质量为y
Na2SO4 + BaCl2 = Ba SO4 + 2 NaCl
142 208 117
X 104g×20% y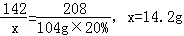
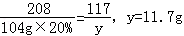
原混合物中NaCl的质量:46.5g﹣14.2g=32.3g
所得溶液中水的质量:72.8g+104g×(1﹣20%)=156g
溶液中NaCl的质量分数=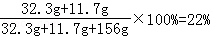
答:(1)原混合物中硫酸钠的质量14.2g;
(2)反应后所得溶液中溶质的质量分数22%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

练习册系列答案
相关题目
将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为
| A.80g | B.100g | C.200g | D.280g |