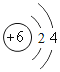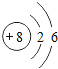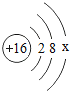题目内容
【题目】下列应用及相应的原理(用化学方程式表示)及基本反应类型均正确的是( )
A.用小苏打治疗胃酸过多2NaHCO3+H2SO4=Na2SO4+H2O+CO2↑ 复分解反应
B.用红磷测定空气中氧气含量4P+5O2![]() 2P2O5 氧化反应
2P2O5 氧化反应
C.用木炭还原氧化铜2CuO+C![]() 2Cu+CO2↑ 化合反应
2Cu+CO2↑ 化合反应
D.用盐酸除铁锈Fe2O3+6HCl=2FeCl3+3H2O 复分解反应
【答案】D
【解析】
A.胃酸中含有盐酸,盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑,属于复分解反应,该选项化学方程式书写不正确;
B.红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5,属于化合反应,氧化反应不属于基本反应类型,该选项基本反应类型判断不正确;
2P2O5,属于化合反应,氧化反应不属于基本反应类型,该选项基本反应类型判断不正确;
C.高温条件下,碳和氧化铜反应生成铜和二氧化碳,反应的化学方程式为:2CuO+C![]() 2Cu+CO2↑,属于置换反应,该选项化学方程式及其基本反应类型判断不正确;
2Cu+CO2↑,属于置换反应,该选项化学方程式及其基本反应类型判断不正确;
D.铁锈主要成分是氧化铁,氧化铁和稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O,属于复分解反应,该选项化学方程式书写及基本反应类型的判断正确。
故选D。

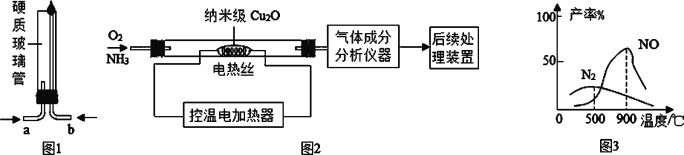
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。三个小组均可采用如图装置进行实验,记录收集 10mL 氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的 H2O2 溶液、MnO2、CuO、红砖粉末。
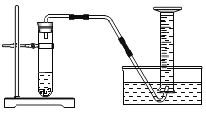
(A 组):探究催化剂对化学反应速率的影响
取 5mL10%H2O2 溶液,三次实验分别加入 0.5gMnO2、红砖粉末、CuO 进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t(秒) | 10 | 60 | 20 |
由此可出结论:MnO2、CuO 对 H2O2 分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为__________。结果:长时间(大于 100s),收集到很少量气体。
更正结论:红砖粉末 _____(选填“有”、“无”)催化作用,三者中 _____催化效率最高。
(B 组):探究浓度对化学反应速率的影响
甲同学:取 10mL5%H2O2 溶液,加入 0.5gMnO2 为催化剂,进行实验,记录时间 t1。 乙同学:取 10mL2.5%H2O2 溶液,加入 0.5gMnO2 为催化剂,进行实验,记录时间 t2。 实验结果 _____。
结论:当催化剂种类相同时,反应物的浓度越大,反应速率越快。
(C 组):探究温度对化学反应速率的影响。
取 10mL5%H2O2 溶液和 0.5gCuO 为催化剂进行实验,两次实验分别将试管置于冰水浴和 50℃热水浴记录时间 t4、t5,且 t4>t5。
结论:当反应物浓度和催化剂相同时,____________。
综上所述:①为了研究某一因素对化学反应速率的影响,必须控制外界其他因素相同.
②探究发现影响化学反应速率的因素有____。
【题目】(1)下表为部分元素的原子结构示意图:
元素名称 | 氢 | 氦 | 碳 | 氧 | 钠 | 硫 |
元素符号 | H | He | C | O | Na | S |
原子结构 示意图 |
|
|
|
|
|
|
请回答下列问题:
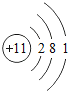
①硫原子的结构示意图的最外层电子数x=_____。
②原子的核外电子排布,特别是最外层的电子数目,与元素的性质有密切的关系。表中具有相对稳定结构的原子是_____(填元素符号)。
③NaH是由离子构成化合物,其形成过程与氯化钠类似。简述NaH的形成过程_____。
④在化学反应中,如果有元素化合价升高,则必定有元素化合价降低。NaH能与水发生化学反应,生成碱和一种气体。甲同学认为生成的气体是O2,乙同学认为生成的气体是H2。从化合价角度分析,你认为哪位同学的说法正确?并说明理由。_____。
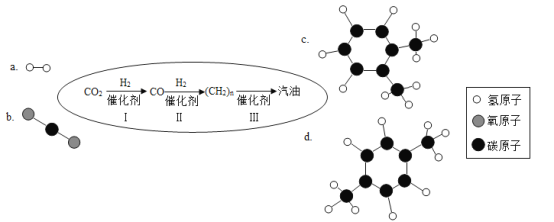
(2)汽车尾气催化转换器可将有害气体转化为无害气体排放,其反应过程的微观变化如下图:
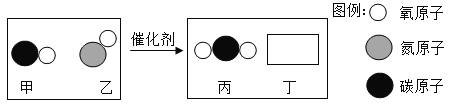
则丁是_____(写化学式),下列说法中正确的有_____。
A 该反应中含氧元素的物质有3种 B 该反应是置换反应
C 参加反应的甲和乙的质量比为14∶15 D 生成丙和丁的分子个数比为1∶1
(3)某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,取一定量该气体按图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重
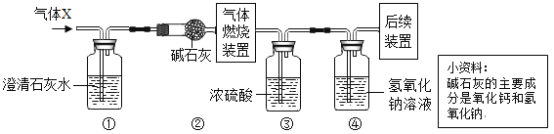
下列关于气体X成分的分析中,正确的有:_____。
A 一定没有二氧化碳 B 可能含有甲烷和氢气
C 可能只有甲烷 D 可能含有氢气和一氧化碳