题目内容
【题目】下列是A、B、C三种固体物质的溶解度曲线如图所示,请回答:
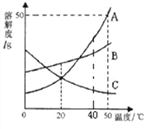
(1)20℃时,A、B、C三种物质的溶解度大小关系是______;
(2)50℃时,向50g水中加入50g A固体,所得溶液中溶质的质量为_______g。
(3)下列说法不正确的是___________。
①将50℃时A、B、C的饱和溶液降温到20℃,溶质质量分数从大到小的顺序是B A=C
②将50℃的C的不饱和溶液变为饱和溶液,溶液质量、溶剂质量、溶质质量分数不一定发生变化
③A中含有少量的B可采用海水晒盐的原理提纯A
④50℃时,将等质量的A、B、C三种物质分别加水完全溶解配制成饱和溶液,A所需要的水最少
⑤分别将40℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出
【答案】 B>A=C(或B>C=A) 25 ①③⑤
【解析】。
本考点考查了溶解度曲线及其应用。
(1)根据溶解度曲线可知:20℃时,A、B、C三种物质的溶解度大小关系是B>A=C(或B>C=A);
(2)50℃时,A的溶解度是50g,即50℃时,100g水中最多溶解A的质量是50g,50g的水中最多溶解25g的A;
(3)①将50℃时A、B、C三种物质的饱和溶液降温到20℃时,A、B的溶解度减小,析出溶质,溶液中溶质质量减小,溶剂质量不变,溶液仍为饱和溶液,溶质的质量分数减小,C的溶解度变大,溶液中溶质、溶剂质量不变,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数= ![]() ×100%,即溶解度大的溶质质量分数大,20℃时B的溶解度大于20℃时A的溶解度大于50℃时C的溶解度,故降温后溶质的质量分数关系为:B>A>C,错误;②C的溶解度随温度的升高而减小,通过升温可将50℃的C的不饱和溶液变为饱和溶液,在这一过程中溶液质量、溶剂质量、溶质质量分数没有发生变化,正确;③A中含有少量B,A的溶解度受温度影响变化大,采用降温结晶的方法提纯A,错误;④50℃时,A物质的溶解度最大,B物质的溶解度次之,C物质的溶解度最小,所以将等质量的A、B、C三种物质分别放入一定量的水中恰好完全溶解,配制成饱和溶液,所需要的水质量由小到大的顺序为A、B、C,A所需要的水最少,正确;⑤分别将50℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出错误,因为没有指明是等质量的饱和溶液,错误。故答案为:①③⑤。
×100%,即溶解度大的溶质质量分数大,20℃时B的溶解度大于20℃时A的溶解度大于50℃时C的溶解度,故降温后溶质的质量分数关系为:B>A>C,错误;②C的溶解度随温度的升高而减小,通过升温可将50℃的C的不饱和溶液变为饱和溶液,在这一过程中溶液质量、溶剂质量、溶质质量分数没有发生变化,正确;③A中含有少量B,A的溶解度受温度影响变化大,采用降温结晶的方法提纯A,错误;④50℃时,A物质的溶解度最大,B物质的溶解度次之,C物质的溶解度最小,所以将等质量的A、B、C三种物质分别放入一定量的水中恰好完全溶解,配制成饱和溶液,所需要的水质量由小到大的顺序为A、B、C,A所需要的水最少,正确;⑤分别将50℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出错误,因为没有指明是等质量的饱和溶液,错误。故答案为:①③⑤。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末。在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:_____;发生的反应方程式是:_____。
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究。
(提出问题):什么导致溶液先变红再褪色?
(猜想与假设):猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”。
(实验与结论):a:甲同学提出的猜想,立即遭到其他同学的反对,因为_____;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
实验步骤 | 实验现象 | 实验结论 |
取少量稀氢氧化钠溶液于试管中,滴加1—2滴酚酞试液,变红后_____观察现象 | 溶液依然为_____色 | _____ |
(讨论交流):你还能提出不同的猜想吗?
猜想3:_____。
方案3:
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |