题目内容
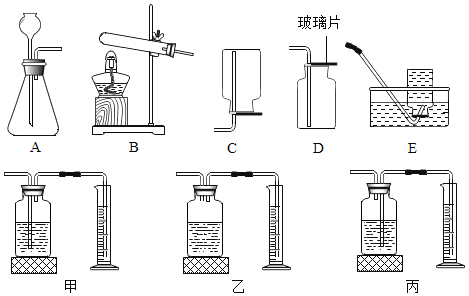
【题目】实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验。请根据实验回答:
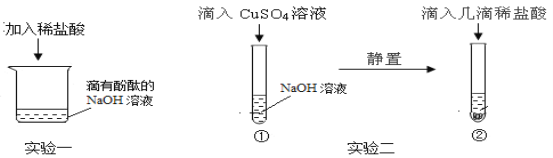
(探究实验一)酸能否与可溶性碱发生化学反应。甲同学进行了实验一,能观察到的明显现象是_____,同时测定反应后溶液的pH=2,说明酸能与可溶性碱发生化学反应。
(探究实验二)酸能否与难溶性碱发生化学反应。乙同学进行了实验二,当滴入几滴稀盐酸后,发现试管②中无明显变化,于是得出“酸不能与难溶性碱反应”的结论。丙同学对此产生质疑,并利用实验后的物质继续探究:
(分析)丙同学测定试管②中上层清液的酸碱度,读出pH=12,说明上层清液中的溶质是_____。
(解释)丙同学由此认为乙同学的结论不正确,原因是_____。
(验证)丙同学利用上述实验后的废液继续实验,将试管②中物质全部倒入一大烧杯中,静置,再将实验探究一所得溶液逐滴加入,能说明酸与难溶性碱发生化学反应的现象是_____,反应的化学方程式是_____。
(拓展)实验探究一、二中,均涉及的反应的化学方程式是_____。丙同学将实验一所得溶液缓慢滴加的过程中,除上述现象外,大烧杯中还可能观察到的现象是_____。
【答案】溶液由红色逐渐变为无色 Na2SO4、NaCl、NaOH 几滴盐酸先与氢氧化钠反应,不能确定酸不与难溶性碱反应(答案合理即可) 蓝色沉淀逐渐溶解(或蓝色沉淀部分溶解或溶液变蓝色) 2HCl+Cu(OH)2=CuCl2+2H2O NaOH+HCl=NaCl+H2O 烧杯中溶液先变红,然后红色消失
【解析】
[探究实验一]氢氧化钠溶液显碱性,能使无色的酚酞试液变红色,向烧杯中滴加稀盐酸,盐酸与氢氧化钠发生中和反应生成氯化钠和水,会观察到溶液的颜色由红色变成了无色;故填:溶液由红色变成了无色;
[探究实验二]
[分析]氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠;若测得试管②清液的pH=12,说明溶液显碱性,存在氢氧化钠,向试管②中滴加的几滴盐酸与氢氧化钠发生了中和反应,还没有来得及与氢氧化铜沉淀反应,所以没有观察到难溶性的氢氧化铜溶解,所以试管②中存在的溶质是氯化钠、硫酸钠、氢氧化钠;故填:氯化钠、硫酸钠、氢氧化钠;
[解释]试管②中的溶液中存在氢氧化钠,加入的盐酸太少,只与氢氧化钠发生了反应,没有与氢氧化铜反应,所以乙同学的结论不正确;
[验证]探究一所得溶液显酸性,存在着HCl,将试管②中物质全部倒入一大烧杯中,静置,再将实验探究一所得溶液逐滴加入,盐酸与氢氧化钠反应生成氯化钠和水,盐酸与氢氧化铜反应生成氯化铜和水,会观察到蓝色沉淀慢慢消失,这说明酸与难溶性碱发生化学反应;稀盐酸与氢氧化铜反应生成氯化铜和水,反应的方程式为2HCl+Cu(OH)2=CuCl2+2H2O;故填:蓝色沉淀慢慢消失;2HCl+Cu(OH)2=CuCl2+2H2O
[拓展]两个实验中均发生了盐酸与氢氧化钠反应生成氯化钠和水这一反应;故填:NaOH+HCl=NaCl+H2O;
因为探究二中的溶液pH=12,显碱性,随着探究一中酸性溶液的加入,溶液慢慢变成中性,滴加过量后,溶液显酸性,因此将实验一所得溶液缓慢滴加的过程中,会观察到溶液由无色变成红色,然后由红色慢慢又变成无色;故填:溶液由无色变成红色,然后由红色慢慢又变成无色.

【题目】人类的生产、生活离不开金属。
(1)铁制品在喷漆前需除锈,可用来除铁锈的物质是_____。
(2)为探究铁、铜、银三种金属的活动性顺序,设计了1、Ⅱ两种方案。
方案1 | 方案Ⅱ |
|
|
能验证三种金属活动性顺序的一种方案是_____写出发生反应的化学方程式_____。