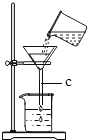
题目内容
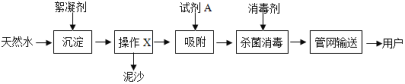
【题目】已知:CO2+H2O+Na2CO3 =2NaHCO3。某温度下,向60.6 g碳酸钠溶液中通入一定量的CO2至碳酸钠恰好完全反应,反应后的溶液中有碳酸氢钠析出,过滤,分别得到11.98 g固体和53.02g溶液。 请计算:
(1)参与反应的CO2质量___________。
(2)过滤后的溶液中,碳酸氢钠与水的质量比__________。
【答案】4.4g 1:10
【解析】
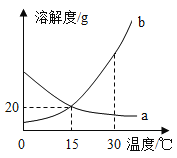
根据质量守恒定律,反应前后物质的总质量不变,碳酸氢钠的溶解度较小,达到饱和时就会结晶析出。
(1)参与反应的CO2质量为![]()
(2)设生成碳酸氢钠质量为x
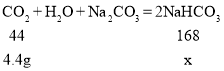
![]()
![]()
溶液中的NaHCO3的质量为![]()
过滤后的溶液中,碳酸氢钠与水的质量比为![]()
答:参与反应的CO2质量为4.4g;过滤后的溶液中,碳酸氢钠与水的质量比为1:10。

练习册系列答案
相关题目
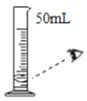
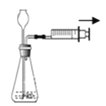
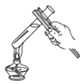
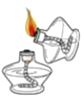
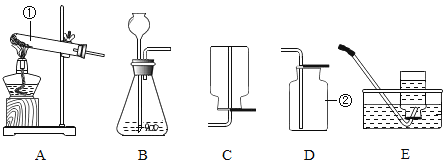
【题目】根据下图回答问题:
实验内容 | 读出量筒液体的体积数 | 向上排空气法收集气体 | 实验室制CO2 | 过滤 | 加热液体药品 |
实验操作图 |
|
|
|
|
|
实验操作图编号 | A | B | C | D | E |
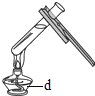
(1)写出上表实验操作图中标有字母d的仪器名称:_____.
(2)上表的实验操作图中有错误的是_____![]() 填番号,下同
填番号,下同![]() 其中_____图中的操作,造成液体沸腾后冲出
其中_____图中的操作,造成液体沸腾后冲出![]() 图中的操作,会造成_____.
图中的操作,会造成_____.