题目内容
【题目】海洋是人类千万年来赖以生存的重要资源宝库。请根据下列图示回答问题:
I.利用海水提取粗盐的过程如图所示,回答有关问题
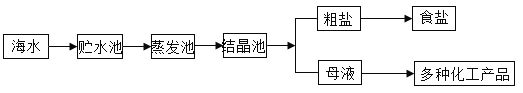
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)在蒸发池中,经过风吹日晒使水分部份蒸发,蒸发的水分子组成__________(填“不变”或“变”),因此该变化是___________。
(3)在结晶池中,继续风吹日晒,海水就会变为食盐的__________溶液(填“饱和”或“不饱和”)。
(4)析出粗盐后,母液中氯化钠的溶质质量分数__________(填“不变”或“变”)。
(5)将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加NaCl的质量是__________(计算结果精确到0.1)。
II.下图是海水制镁的流程,请回答下列问题:
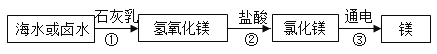
上述一系列转化过程中,属于中和反应的是________________(用化学方程式表示),①步骤中加入石灰乳的量应__________,要得到氢氧化镁固体①步骤中需进行的操作是__________。
②海水制镁过程中对于如何富集镁离子,甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳;乙:高温加热蒸发海水后,加入石灰乳;
丙:向晒盐后的卤水中,加入石灰乳。
通过分析比较,你认为________的设想最经济合理(选填“甲”、“乙”或“丙”)。
III.我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
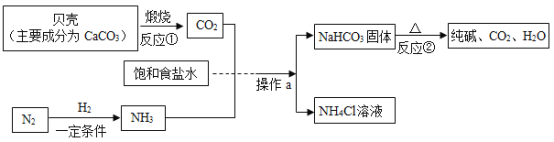
(1)写出上述反应带标号的化学方程式:①________________,②________________。
(2)工业上用分离液态空气的方法制取氮气,属于_________变化(填“物理”或“化学”)。根据上图试着写出制取氨气的化学方程式________________。
(3)操作a的名称是_________,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、_________。
(4)![]() 溶液中会电离出自由移动的_________和_________(填离子符号),写出
溶液中会电离出自由移动的_________和_________(填离子符号),写出![]() 的一种用途___________。
的一种用途___________。
【答案】不变 不变 物理变化 饱和 不变 17.5g ![]() 过量 蒸发 丙
过量 蒸发 丙 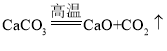
![]() 物理
物理 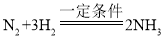 过滤 漏斗
过滤 漏斗 ![]()
![]() 化肥,氮肥
化肥,氮肥
【解析】
I.根据海水提取粗盐的过程可知:
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,水的质量减小,蒸发池中氯化钠的质量不变。
(2)在蒸发池中,经过风吹日晒使水分部份蒸发,蒸发的水分子组成不变,因此该变化是物理变化。
(3)在结晶池中,继续风吹日晒,有晶体析出,海水就会变为食盐的饱和溶液。
(4)析出粗盐后,母液仍然为氯化钠的饱和溶液,母液中氯化钠的溶质质量分数不变。
(5)设将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加NaCl的质量是x,则有:
![]() 解得x=17.5g
解得x=17.5g
故将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为20%的氯化钠溶液,需要再加NaCl的质量是17.5g。
II.根据海水制镁的流程图可知:
一系列转化过程中,属于中和反应的是氢氧化镁与盐酸的反应,生成氯化镁和水,反应的化学方程式为![]() ,①步骤中加入石灰乳的量应过量,要得到氢氧化镁固体①步骤中需进行的操作是过滤。
,①步骤中加入石灰乳的量应过量,要得到氢氧化镁固体①步骤中需进行的操作是过滤。
②通过分析比较三种设想,丙的设想最经济合理。因为与甲相比,卤水是海水蒸发浓缩所得,镁离子浓度大,更有利于富集,与乙比较,不需要加热,直接用太阳光晒,节约能源,所以丙最经济合理。
III.根据“侯氏制碱法”的模拟流程可知:
(1)①为碳酸钙高温条件下分解生成氧化钙和二氧化碳,反应的化学方程式为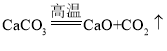 ;②碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为
;②碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为![]() 。
。
(2)工业上用分离液态空气的方法制取氮气,属于物理变化。根据上图可知用氮气和氢气在一定条件下制取氨气,反应的化学方程式为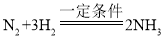 。
。
(3)操作a分离固体和液体,操作的名称是过滤,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、漏斗。
(4)![]() 溶液中会电离出自由移动的
溶液中会电离出自由移动的![]() 和
和![]() ,
,![]() 中含有氮元素,可以用作化肥,氮肥。
中含有氮元素,可以用作化肥,氮肥。

 步步高达标卷系列答案
步步高达标卷系列答案