题目内容
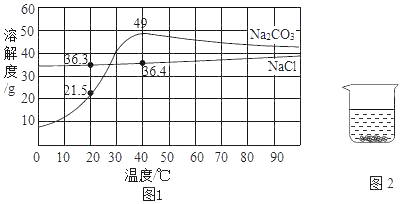
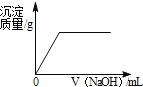
【题目】a、b 两种物质的溶解度曲线如图所示.下列说法不正确的是( )
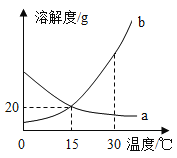
A.15℃时,a、b 的溶解度均为20g
B.加水或升温均可使b的饱和溶液变为不饱和溶液
C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D.分别向100g 水中加入20ga和 b,升温至30℃,所得溶液均 为饱和溶液
【答案】D
【解析】
A、根据溶解度曲线可知15℃时,a、b 的溶解度均为20g,故A正确;
B、b物质的溶解度随温度的升高而增大,所以加水或升温均可使b的饱和溶液变为不饱和溶液,故B正确;
C、a物质的溶解度随温度的降低而增大,所以将 30℃时a的饱和溶液降温至15℃,没有晶体析出,溶液变为不饱和溶液,但溶质的质量分数不变,故C正确;
D、b物质的溶解度随温度的升高而增大,所以向100g 水中加入20ga和b,升温至30℃,所得溶液变为b的不饱和溶液,故D错误.
故选:D.

 名校课堂系列答案
名校课堂系列答案【题目】根据氯化钠和硝酸钾的溶解度表,回答下列问题:
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
氯化钠溶解度(克) | 35.8 | 36.0 | 36.3 | 36.4 | 37.0 | 37.3 | 37.8 |
硝酸钾溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
(1)写出硝酸钾和氯化钠具相同溶解度时的温度范围(限表中相邻两个温度之间)_____;
(2)50℃,向100克水中加入90克硝酸钾,充分搅拌后所的溶液质量为_____;
(3)计算20℃时氯化钠饱和溶液的溶质质量分数_____.(写出计算过程)
【题目】下表是 NaHCO3和NH4Cl在不同温度下的溶解度。下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度/g | NaHCO3 | 10.0 | 11.0 | 13.0 | 14.0 |
NH4Cl | 35.0 | 39.0 | 43.0 | 48.0 | |
A.20℃时,配制等质量的 NaHCO3和NH4Cl饱和溶液,NH4Cl需要水少
B.饱和氨盐水吸收CO2后生成的 NaHCO3和NH4Cl,NaHCO3先结晶析出
C.20℃时,NaHCO3饱和溶液的溶质质量分数为10%
D.50℃时,148g NH4Cl饱和溶液降温到20℃,析出13 g NH4Cl晶体