题目内容
【题目】如图所示为实验室常见气体制备、净化、干燥、收集和性质等实验的部分仪器,某校化学实验小组的同学完成下列实验探究:
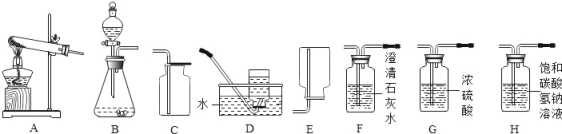
①一组同学欲制取硫化氢气体:查阅资料知,通常情况下,硫化氢气体是一种无色有臭鸡蛋气味的有毒气体,密度比空气大,能溶于水,其水溶液叫氢硫酸(H2S)。实验室用硫化亚铁固体与稀盐酸反应制取硫化氢气体时,应选择的发生装置为_____(填字母),能否用D装置收集硫化氢气体,并说明理由_____。为了防止中毒和污染空气,多余的硫化氢气体可用氢氧化钠溶液吸收,其反应的化学方程式为_____(氢硫酸跟稀盐酸一样,能与碱发生中和反应)。
②二组同学以石灰石和稀盐酸为原料,制备并收集一瓶干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。所选仪器的连接顺序应为_____(填写字母序号),用化学方程式表示饱和NaHCO3溶液的作用_____。若将二氧化碳通入澄清的石灰水中,写出发生反应的化学方程式_____。
【答案】B 不能,因为硫化氢气体能溶于水 H2S+2NaOH=Na2S+2H2O BHGC HCl+NaHCO3=NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
①实验室用硫化亚铁固体与稀盐酸反应制取硫化氢气体时,因此不需要加热;不能用D装置收集硫化氢气体,因为硫化氢气体能溶于水;硫化氢气体与氢氧化钠溶液反应生成硫化钠和水,配平即可;故答案为:B;不能,因为硫化氢气体能溶于水;H2S+2NaOH=Na2S+2H2O;
②实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;要先除杂质再干燥,最后收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;故答案为:BHGC;HCl+NaHCO3=NaCl+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;

【题目】“卓筒井”是手工制盐的活化石,是我国古代劳动人民勤劳、智慧的象征。其工艺流程包括下面五个步骤:钻井→汲卤→晒卤→滤卤→煎盐。请回答下列问题:
(1)上述步骤中,_____与实验室过滤的原理一样,“煎盐”和实验室_____结晶的原理相同。
(2)“汲卤”获得卤水主要成分是氯化钠与氯化钾,卤水中氯化钠的质量分数大约为 7%~10%,“晒卤”目的是_____;“煎盐”得到的食盐中含有氯化钾,实验室可用_____检验,操作方法是_____。
(3)下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 g/100g 水 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
根据表中数据可得出:40℃时,氯化钠溶解度_____氯化钾溶解度(填:大于、小于、等于); 氯化钠与氯化钾溶解度相同的温度范围是_____;20℃时,100g 卤水氯化钠的质量分数为 9%,含氯化钾 1.00g,蒸发掉水大于_____g,开始有氯化钠析出。

