题目内容
 化学兴趣小组对实验室的某废液的成分进行探究,老师告诉他们废液中可能含有:NaOH、Na2CO3、CuSO4中的一种或几种.为确定废液的组成,该小组同学做了如下探究:
化学兴趣小组对实验室的某废液的成分进行探究,老师告诉他们废液中可能含有:NaOH、Na2CO3、CuSO4中的一种或几种.为确定废液的组成,该小组同学做了如下探究:
[实验步骤]
(1)小军观察到废液为无色溶液,于是他判断废液中一定没有________.
(2)小敏取出适量废液,向其中滴加几滴无色酚酞溶液,溶液呈红色,她判断废液一定含有NaOH.但是小旻提出质疑.他认为小敏的判断不一定正确,他的理由是________.
(3)为了证明小旻的判断,小军取少量废液于试管中,向废液中滴加过量的CaCl2溶液,并不断振荡.观察到有________生成,说明废液中一定有碳酸钠.
(4)静置后,取步骤(3)试管中的少量上层清液,滴加几滴酚酞溶液.小军观察到溶液不变色.说明废液中一定没有________.
[实验结论]
①废液中含有________.
②实验室的废液未经处理直接倒入下水道是不允许的,他们的理由是________(写一条).
[实验反思]
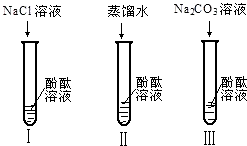
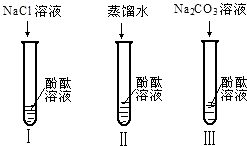
不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红.碱溶液可以使酚酞溶液变红,是因为碱在水溶液中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?小军他们又设计了如图三个实验,请你和他们一起探究.
①实验Ⅰ可以证明________.
②实验Ⅱ加入蒸馏水的目的是________.小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是________.
③实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到产生________现象.反应的化学方程式为________.由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞溶液变红.
解:(1)硫酸铜溶液是蓝色的,而废液为无色溶液,说明一定不含有硫酸铜,故填:CuSO4;
(2)氢氧化钠溶液和碳酸钠溶液都呈碱性,都能使酚酞试液变红,所以酚酞试液变红,不能说明一定含有氢氧化钠,故填:Na2CO3溶液呈碱性;
(3)碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀,一定含有碳酸钠,则加入氯化钙会出现白色沉淀,故填:白色沉淀;
(4)碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,滴入酚酞试液不变色,说明一定不含有氢氧化钠,故填:NaOH;
实验结论:①根据实验可以看出,废液中含有碳酸钠,故填:Na2CO3;
②废液中含有的物质会造成水体污染,不能直接排放到下水道中,故填:废液易造成水体污染;
实验反思:①实验Ⅰ是在氯化钠溶液中加入酚酞试液,试液不变色,证明钠离子不能使酚酞变色,故填:Na+不能使酚酞试液变红;
②实验Ⅱ加入蒸馏水,在蒸馏水中酚酞不变色,证明水分子不能使酚酞变色,由于酚酞试液中本身就含有水分子,该实验没有必要做,故填:水分子不能使酚酞变红,酚酞试液中含有水分子;
③滴入氯化钙溶液,能与碳酸钠溶液反应生成碳酸钙白色沉淀和氯化钠,红色褪去是由于碳酸根离子消失,故说明碳酸钠溶液中使酚酞变色的是碳酸根离子,故填:产生白色沉淀,Na2CO3+CaCl2=CaCO3↓+2NaCl.
分析:根据已有的知识进行分析,硫酸铜溶液是蓝色的,氢氧化钠溶液和碳酸钠溶液都呈碱性,都能使酚酞试液变红,碳酸钠能与氯化钙反应生成碳酸钙白色沉淀,据此解答即可.
点评:本题考查了物质成分的推断以及溶液中使指示剂变色的离子的实验探究,完成此题,可以依据已有的物质的性质结合物质间反应的实验现象进行.
(2)氢氧化钠溶液和碳酸钠溶液都呈碱性,都能使酚酞试液变红,所以酚酞试液变红,不能说明一定含有氢氧化钠,故填:Na2CO3溶液呈碱性;
(3)碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀,一定含有碳酸钠,则加入氯化钙会出现白色沉淀,故填:白色沉淀;
(4)碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,滴入酚酞试液不变色,说明一定不含有氢氧化钠,故填:NaOH;
实验结论:①根据实验可以看出,废液中含有碳酸钠,故填:Na2CO3;
②废液中含有的物质会造成水体污染,不能直接排放到下水道中,故填:废液易造成水体污染;
实验反思:①实验Ⅰ是在氯化钠溶液中加入酚酞试液,试液不变色,证明钠离子不能使酚酞变色,故填:Na+不能使酚酞试液变红;
②实验Ⅱ加入蒸馏水,在蒸馏水中酚酞不变色,证明水分子不能使酚酞变色,由于酚酞试液中本身就含有水分子,该实验没有必要做,故填:水分子不能使酚酞变红,酚酞试液中含有水分子;
③滴入氯化钙溶液,能与碳酸钠溶液反应生成碳酸钙白色沉淀和氯化钠,红色褪去是由于碳酸根离子消失,故说明碳酸钠溶液中使酚酞变色的是碳酸根离子,故填:产生白色沉淀,Na2CO3+CaCl2=CaCO3↓+2NaCl.
分析:根据已有的知识进行分析,硫酸铜溶液是蓝色的,氢氧化钠溶液和碳酸钠溶液都呈碱性,都能使酚酞试液变红,碳酸钠能与氯化钙反应生成碳酸钙白色沉淀,据此解答即可.
点评:本题考查了物质成分的推断以及溶液中使指示剂变色的离子的实验探究,完成此题,可以依据已有的物质的性质结合物质间反应的实验现象进行.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
 化学兴趣小组对实验室的某废液的成分进行探究,老师告诉他们废液中可能含有:NaOH、Na2CO3、CuSO4中的一种或几种.为确定废液的组成,该小组同学做了如下探究:
化学兴趣小组对实验室的某废液的成分进行探究,老师告诉他们废液中可能含有:NaOH、Na2CO3、CuSO4中的一种或几种.为确定废液的组成,该小组同学做了如下探究: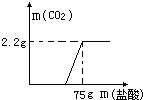 某化学兴趣小组对实验室留置的NaOH的变质程度进行探究.先称取13.3gNaOH样品(杂质为Na2CO3 ),配制成50g溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,实验测得加入稀盐酸的质量与产生CO2 气体的质量关系如图.试计算:
某化学兴趣小组对实验室留置的NaOH的变质程度进行探究.先称取13.3gNaOH样品(杂质为Na2CO3 ),配制成50g溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,实验测得加入稀盐酸的质量与产生CO2 气体的质量关系如图.试计算: