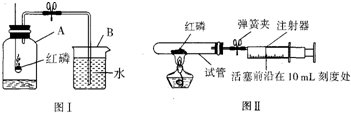
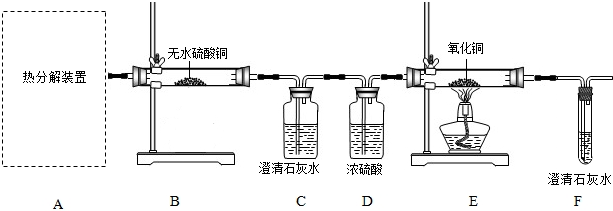
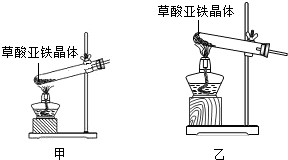
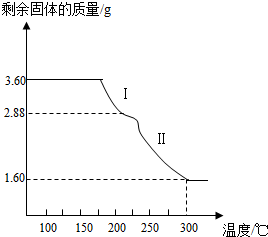
题目内容
某化学兴趣小组对实验室留置的NaOH的变质程度进行探究.先称取13.3gNaOH样品(杂质为Na2CO3 ),配制成50g溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,实验测得加入稀盐酸的质量与产生CO2 气体的质量关系如图.试计算:(1)有多少克NaOH发生了变质?
(2)反应所得溶液中溶质的质量分数是多少?

【答案】分析:(1)根据盐酸与碳酸钠反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出该样品中碳酸钠的质量以及生成的氯化钠的质量;根据氢氧化钠与二氧化碳反应生成了碳酸钠,由碳酸钠的质量求出变质的氢氧化钠的质量.
(2)根据题意可知,反应所得溶液中溶质是氯化钠,溶质的来源有两个途径,一是碳酸钠与盐酸反应的生成的,二是由氢氧化钠与盐酸反应生成的,分别由方程式求出,再根据溶质质量分数的计算公式计算出溶质的质量分数.
解答:解:(1)设该样品中Na2CO3的质量是x,生成的NaCl的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
 x=5.3g
x=5.3g
 y=5.85g
y=5.85g
再设变质的氢氧化钠的质量为z
2NaOH+CO2═Na2CO3+H2O
80 106
z 5.3g
 z=4g
z=4g
(2)未变质的氢氧化钠的质量为:13.3g-5.3g=8g,
设8g氢氧化钠与盐酸反应生成的氯化钠的质量为p
NaOH+HCl=NaCl+H2O
40 58.5
8g p
 p=11.7g
p=11.7g
反应所得溶液中溶质的质量分数是: ×100%=14.3%.
×100%=14.3%.
答:(1)有4克NaOH发生了变质;(2)反应所得溶液中溶质的质量分数是14.3%.
点评:通过本题的练习,学会分析图象并得出相应数据的方法,解答本题时要注意溶液中的溶质的来源有两种,一是碳酸钠与盐酸反应生成的,二是由氢氧化钠与盐酸反应生成的.
(2)根据题意可知,反应所得溶液中溶质是氯化钠,溶质的来源有两个途径,一是碳酸钠与盐酸反应的生成的,二是由氢氧化钠与盐酸反应生成的,分别由方程式求出,再根据溶质质量分数的计算公式计算出溶质的质量分数.
解答:解:(1)设该样品中Na2CO3的质量是x,生成的NaCl的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
 x=5.3g
x=5.3g y=5.85g
y=5.85g再设变质的氢氧化钠的质量为z
2NaOH+CO2═Na2CO3+H2O
80 106
z 5.3g
 z=4g
z=4g(2)未变质的氢氧化钠的质量为:13.3g-5.3g=8g,
设8g氢氧化钠与盐酸反应生成的氯化钠的质量为p
NaOH+HCl=NaCl+H2O
40 58.5
8g p
 p=11.7g
p=11.7g反应所得溶液中溶质的质量分数是:
 ×100%=14.3%.
×100%=14.3%.答:(1)有4克NaOH发生了变质;(2)反应所得溶液中溶质的质量分数是14.3%.
点评:通过本题的练习,学会分析图象并得出相应数据的方法,解答本题时要注意溶液中的溶质的来源有两种,一是碳酸钠与盐酸反应生成的,二是由氢氧化钠与盐酸反应生成的.

练习册系列答案
相关题目