题目内容
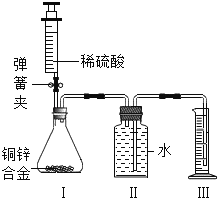
【题目】根据如图所示的四个实验,回答下列问题。
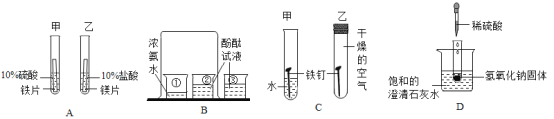
(1)实验A中从乙试管中产生气泡速率大于甲试管中产生气泡速率,是否能说明金属活动性:镁>铁_____(填“是”或“否”)。
(2)B实验中烧杯③的作用是_____。
(3)从C中甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明铁生锈需要的条件_____。
(4)D图中向盛有NaOH固体的试管中滴加稀硫酸,能观察到_____的现象。
【答案】否 对照 与水接触 试管中固体消失,澄清石灰水变浑浊
【解析】
(1)甲乙两只试管中所放置的酸不一样,因此不能说明两种金属的活动性;
(2)烧杯内外的空气中只有氨分子的差异,因此B实验中烧杯③的作用是对照;
(3)C 中乙试管内只有空气,铁钉没有生锈,甲试管中铁铁钉与空气和水同时接触生锈,因此说明铁生锈需要的条件与水接触;
(4)当稀硫酸滴入氢氧化钠固体中后,氢氧化钠和稀硫酸反应放出热量,使得烧杯中的温度升高,氢氧化钙的溶解度随温度的升高是降低的,因此看到的现象是:试管内固体溶解,澄清石灰水变浑浊。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目