题目内容
【题目】漂白液是家庭常用的洗涤剂。工业上常用氢氧化钠溶液吸收氯气来制漂白液,反应的化学方程式是Cl2+2NaOH═NaClO+NaCl+H2O。现向氢氧化钠溶液中通入氯气,恰好完全反应,得到含次氯酸钠(NaClO)5%的漂白液(漂白液中的溶质是氯化钠和次氯酸钠)1490g,请计算:
(1)上述反应方程式中,NaClO中氯元素的化合价____。
(2)已知含次氯酸钠0.05%的漂白液用于家居消毒效果最佳。现取5g制得的漂白液,为了达到最佳的消毒效果,需加入水的质量为_____g。
(3)原氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。____
【答案】+1 495 5.6%
【解析】
(1)NaClO中钠的化合价为+1,氧的化合价为-2,设氯元素的化合价为x,则(+1)+x+(-2)=0,得x=+1,故氯元素的化合价为+1价;
(2)溶液稀释前后溶质的质量不变,设现取5g制得的漂白液,为了达到最佳的消毒效果,需加入水的质量为x
(5g+x)×0.05%=5g×5%
x=495g
(3)设氢氧化钠的质量为x,参与反应的Cl2的质量为y。

![]() ,
,![]()
x=80g y=71g
原NaOH溶液中溶质质量分数为![]()
答:原氢氧化钠溶液中溶质质量分数约为5.6%。

练习册系列答案
相关题目
【题目】依据下列实验室制取气体的发生和收集装置,选择“I”或“II”进行作答,二者均作答,按“I”进行计分。
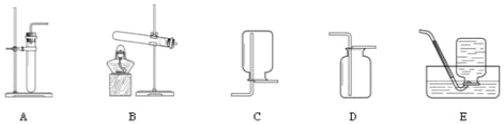
I | II |
(1)实验室用高锰酸钾制取氧气的化学方程式是_____,发生装置选择_____。 (2)氧气可选用E进行收集,其原因是_____。 | (1)实验室制取二氧化碳的化学方程式是_____,收集装置选择_____。 (2)二氧化碳的验满方法是_____。 |