题目内容
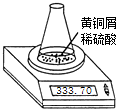 测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是________.若该数据用a表示,求黄铜屑中锌的质量分数(写出计算过程).
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.
解:(1)因为锌铜合金中的锌可以与稀硫酸反应生成氢气,结合表中所给数据可知,锥形瓶总质量的减少量即为氢气的生成量,即:反应生成氢气的总质量:335.70g-335.30g=0.4g
故答案为:0.4g;
(2)锌的质量分数= ×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
故答案为:黄铜屑的质量;
设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
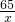 =
= ,
,
解得x=13g
锌的质量分数= ×100%=
×100%= ×100%
×100%
答:黄铜屑中锌的质量分数为 ×100%.
×100%.
(3)称取一定量黄铜屑,与足量盐酸反应后,洗涤不溶物,干燥,称重,从而计算锌的质量分数.
分析:(1)根据质量守恒定律,反应生成的H2的总质量为反应前后烧杯及所盛物质总质量之差.
(2)黄铜屑中锌的质量可以根据锌与硫酸的反应,结合产生的氢气的质量计算得到,计算锌的质量分数,还必须知道黄铜屑的总质量(用a表示).
(3)根据锌与铜的化学性质知,锌与稀盐酸也可以发生反应,而铜与稀盐酸不发生反应.
点评:本题以硫酸和金属(Zn)的反应为实验原理,将实验数据以表格的形式呈现,考查了阅读、分析、处理数据和化学计算的能力.
故答案为:0.4g;
(2)锌的质量分数=
 ×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;
×100%,而锌的质量可以通过释放氢气的质量求出,但缺少黄铜的质量;故答案为:黄铜屑的质量;
设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
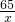 =
= ,
,解得x=13g
锌的质量分数=
 ×100%=
×100%= ×100%
×100%答:黄铜屑中锌的质量分数为
 ×100%.
×100%.(3)称取一定量黄铜屑,与足量盐酸反应后,洗涤不溶物,干燥,称重,从而计算锌的质量分数.
分析:(1)根据质量守恒定律,反应生成的H2的总质量为反应前后烧杯及所盛物质总质量之差.
(2)黄铜屑中锌的质量可以根据锌与硫酸的反应,结合产生的氢气的质量计算得到,计算锌的质量分数,还必须知道黄铜屑的总质量(用a表示).
(3)根据锌与铜的化学性质知,锌与稀盐酸也可以发生反应,而铜与稀盐酸不发生反应.
点评:本题以硫酸和金属(Zn)的反应为实验原理,将实验数据以表格的形式呈现,考查了阅读、分析、处理数据和化学计算的能力.

练习册系列答案
相关题目
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):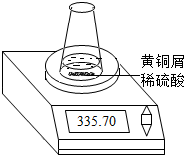
(1)反应生成氢气的总质量为 g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是 .
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).

| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 烧杯及所盛 物质总质量/g |
335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
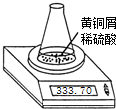 测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):
测定黄铜屑(锌铜合金)的组成有多种方案.某学习小组用图示装置测定黄铜屑中锌的质量分数,取一定量黄铜屑放入锥形瓶中,并加入足量稀硫酸.不同时间电子天平的读数如下表所示(不考虑H2O逸出及溶液温度变化):| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 锥形瓶及所盛物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是
(3)请你再设计一个测定黄铜屑中锌的质量分数的方案.
人类生活离不开金属.
(1)生活中应用铁锅炒菜,主要是运用了铁具有 性(填“导热”或“延展”).
(2)如图是某“取暖片”的图片.该“取暖片”的发热过程是利用铁生锈的原理,铁生锈是铁与水和 共同作用的结果.

(3)应用金属活动性顺序能帮助我们进一步学习金属的性质.已知下列每组物质均能发生置换反应.
A.Fe和CuSO4溶液B.Mn和FeSO4溶液
①写出Mn和FeSO4溶液反应的化学方程式(Mn在生成物中显+2价) .
②由上述信息得出Fe、Cu、Mn三种金属的活动性由强到弱的顺序为 .
(4)为了测定黄铜屑(锌铜合金)中锌的质量分数,同学们进行了以下实验:取20g黄铜屑放入锥形瓶中,再加入足量的稀硫酸,观察到不同时刻天平的读数如下表所示:
请计算反应生成氢气的总质量为 g,黄铜屑中锌的质量分数为 .
(1)生活中应用铁锅炒菜,主要是运用了铁具有
(2)如图是某“取暖片”的图片.该“取暖片”的发热过程是利用铁生锈的原理,铁生锈是铁与水和

(3)应用金属活动性顺序能帮助我们进一步学习金属的性质.已知下列每组物质均能发生置换反应.
A.Fe和CuSO4溶液B.Mn和FeSO4溶液
①写出Mn和FeSO4溶液反应的化学方程式(Mn在生成物中显+2价)
②由上述信息得出Fe、Cu、Mn三种金属的活动性由强到弱的顺序为
(4)为了测定黄铜屑(锌铜合金)中锌的质量分数,同学们进行了以下实验:取20g黄铜屑放入锥形瓶中,再加入足量的稀硫酸,观察到不同时刻天平的读数如下表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| 锥形瓶及所盛物质总质量/g | 220.70 | 220.44 | 220.34 | 220.30 | 220.30 |
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
某学习小组的同学们用下图所示装置测定黄铜屑(锌铜合金)的组成,他们首先取一定量的黄铜屑放入锥形瓶中,并加入足量的稀硫酸.然后观察到不同时间电子天平的读数如下表所示(不考虑水逸出):
(1)反应生成氢气的总质量为______g.
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
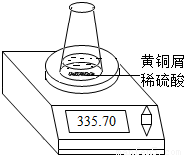
| 反应时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 烧杯及所盛 物质总质量/g | 335.70 | 335.54 | 335.44 | 335.38 | 335.34 | 335.32 | 335.31 | 335.30 | 335.30 |
(2)若要计算黄铜屑中锌的质量分数,还缺少的数据是______.
(3)若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程).
