题目内容
人类生活离不开金属.(1)生活中应用铁锅炒菜,主要是运用了铁具有
(2)如图是某“取暖片”的图片.该“取暖片”的发热过程是利用铁生锈的原理,铁生锈是铁与水和

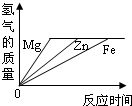
(3)应用金属活动性顺序能帮助我们进一步学习金属的性质.已知下列每组物质均能发生置换反应.
A.Fe和CuSO4溶液B.Mn和FeSO4溶液
①写出Mn和FeSO4溶液反应的化学方程式(Mn在生成物中显+2价)
②由上述信息得出Fe、Cu、Mn三种金属的活动性由强到弱的顺序为
(4)为了测定黄铜屑(锌铜合金)中锌的质量分数,同学们进行了以下实验:取20g黄铜屑放入锥形瓶中,再加入足量的稀硫酸,观察到不同时刻天平的读数如下表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| 锥形瓶及所盛物质总质量/g | 220.70 | 220.44 | 220.34 | 220.30 | 220.30 |
分析:(1)从铁锅炒菜需要传热考虑;
(2)①从铁生锈的条件考虑,铁只有与水、空气同时接触时才生锈,如果有酸、碱、盐溶液存在时,会使生锈速度加快.
(3)用金属活动性顺序的规律解决,排在前面的金属可以把后面的金属从它的盐溶液中置换出来.
(4)根据锌铜合金中的锌可与稀硫酸的反应原理并结合题中所给表格分析即可;根据合金中锌的质量分数的计算方法分析即可.
(2)①从铁生锈的条件考虑,铁只有与水、空气同时接触时才生锈,如果有酸、碱、盐溶液存在时,会使生锈速度加快.
(3)用金属活动性顺序的规律解决,排在前面的金属可以把后面的金属从它的盐溶液中置换出来.
(4)根据锌铜合金中的锌可与稀硫酸的反应原理并结合题中所给表格分析即可;根据合金中锌的质量分数的计算方法分析即可.
解答:解:(1)铁锅炒菜需要传热,铁锅主要是运用了铁具有的导热性.
故答案为:导热;
(2)铁要与水、氧气气同时接触才能生锈,缺一不可.
故答案为:空气或氧气(O2);
(3)①因Mn和FeSO4溶液反应的化学是置换反应,又因Mn在生成物中显+2价.据此写出化学反应式是:Mn+FeSO4=Fe+MnSO4.故答案为:Mn+FeSO4=Fe+MnSO4;
②从化学反应可判断:铁能置换铜,化学方程式为Fe+CuSO4═FeSO4+Cu.镁能置换铁,那么活动性顺序为:镁>铁>铜.
故答案为:Mn>Fe>Cu.
(4)因为锌铜合金中的锌可以与稀硫酸反应生成氢气,结合表中所给数据可知,锥形瓶总质量的减少量即为氢气的生成量,即:反应生成氢气的总质量:220.70g-220.30g=0.4g
锌的质量分数=
×100%,而锌的质量可以通过释放氢气的质量求出.
设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
=
x=13g
锌的质量分数=
×100%=65%
故答案为:0.4;65%.
故答案为:导热;
(2)铁要与水、氧气气同时接触才能生锈,缺一不可.
故答案为:空气或氧气(O2);
(3)①因Mn和FeSO4溶液反应的化学是置换反应,又因Mn在生成物中显+2价.据此写出化学反应式是:Mn+FeSO4=Fe+MnSO4.故答案为:Mn+FeSO4=Fe+MnSO4;
②从化学反应可判断:铁能置换铜,化学方程式为Fe+CuSO4═FeSO4+Cu.镁能置换铁,那么活动性顺序为:镁>铁>铜.
故答案为:Mn>Fe>Cu.
(4)因为锌铜合金中的锌可以与稀硫酸反应生成氢气,结合表中所给数据可知,锥形瓶总质量的减少量即为氢气的生成量,即:反应生成氢气的总质量:220.70g-220.30g=0.4g
锌的质量分数=
| 锌的质量 |
| 黄铜屑量 |
设:锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
| 65 |
| X |
| 2 |
| 0.4 |
x=13g
锌的质量分数=
| 13 |
| 20 |
故答案为:0.4;65%.
点评:熟悉金属生锈的条件,明确只有满足生锈的条件时金属才能生锈.熟记金属活动性顺序,并能熟练的运用它.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
 (2012?通州区二模)人类生活离不开金属.
(2012?通州区二模)人类生活离不开金属.
 人类生活离不开金属.铁是生活中常用的金属.下图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.
人类生活离不开金属.铁是生活中常用的金属.下图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.  人类生活离不开金属.铁是生活中常用的金属.右图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.
人类生活离不开金属.铁是生活中常用的金属.右图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.